 |
| トップページ > 生細胞ミトコンドリア内膜の抗酸化状態をモニターするための α-トコフェロールアナログ |
 |
Photopharmacology : 光異性体による薬効制御株式会社同仁化学研究所 田中 智也
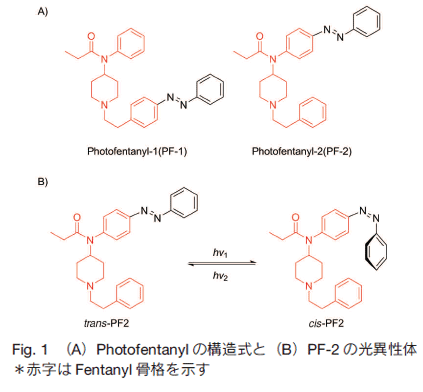 次に、Schönberger らは MOR と GIRK チャネルを発現させた HEK293t 細胞を用いて、 PF2 がリガンドとしての機能を有していることを、カリウムイオンの流出に伴う電流値の変化量から確認した。その結果、trans-PF2 (暗色下と波長 420 〜 480 nm)は MOR のアゴニストとして作用し、MOR が活性化されており、一方、cis-PF2 (波長 360 nm )は、 MOR が不活性状態となっていることが示唆された。 trans-PF2 の MOR 活性化率は内因性の低分子ペプチドであるエンケフェリンと比較して、80% であったことから、trans-PF2 はオピオイドとしての機能を十分に有していた。ただし、PF1 は上記のような、生物学的活性を示さなかったことから、フォトスイッチ基の導入部位も活性を制御する上で重要な要素になると言える。  もちろん、フォトスイッチ基はアゾベンゼンだけに限らない。 Chen らは光照射により閉環・開環状態をとる 1,2-Dithienylethene 骨格を利用したアセチルコリンエステラーゼ(AChE)の阻害剤を開発した(Fig. 3) 5)。この化合物は 1,2-Dithienylethene 骨格の両端に、AChE 阻害活性を持つタクリンを導入することで、AChE 阻害活性を制御している。  今回挙げた報告例の共通点は既存の化合物にフォトスイッチ基を導入することで、その化合物の性質を光で制御できるところである。フォトスイッチ基の種類や導入部位には検討の必要があるが、この手法は既存の酵素阻害剤やリガンドといった生理活性を持つ多くの化合物に幅広く応用されることが期待できる。Photopharmacology のコンセプトは薬剤の開発だけでなく、生命現象の解明を行う上で、有用なツールとなるだろう。
参考文献1) W. A. Velema, W. Szymanski and B. L. Feringa, J. Am. Chem. Soc., 2014, 136, 2178. 2) M. Schönberger and D. Trauner, Angew. Chem. Int. Ed., 2014, 53, 3264. 3) W. A. Velema, J. P. van der Berg, M. J. Hansen, W. Szymanski, A. J. M. Driessen and B. L. Feringa, Nat. Chem., 2013, 5, 924. 4) A. Polosukhina, J. Litt, I. Tochitsky, J. Nemargut, Y. Sychev, I. De Kouchkovsky, T. Huang, K. Borges, D. Trauner, R. N. Van Gelder and R. H. Krameremail, Neuron., 2012, 75(2), 271. 5) X. Chen, S. Wehle, N. Kuzmanovic, B. Merget, U. Holzgrabe, B. König, C. A. Sotriffer and M. Decker, ACS Chem. Neurosci., 2014, in press.
|
| Copyright(c) 1996-2014 DOJINDO LABORATORIES, ALL Rights Reserved. |