生細胞ミトコンドリア内膜の抗酸化状態をモニターするためのα-トコフェロールアナログ
株式会社同仁化学研究所 久保 亮二
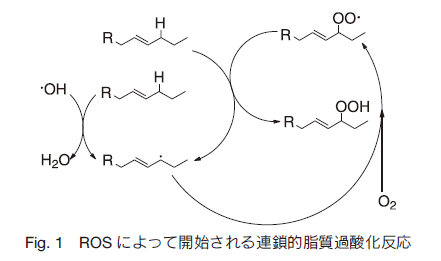
ミトコンドリア内膜は電子伝達系における副産物としての活性酸素種(reactive oxygen species: ROS)の主要な生成部位である。ミトコンドリア内膜中の多価不飽和脂肪酸(PUFA)は ROS の影響を特に受けやすく、ヒドロキシラジカルなどの ROS によって開始される連鎖的脂質過酸化反応により PUFA は次々と酸化される(Fig. 1)。
この時、脂質ペルオキシルラジカルの反応は他のフリーラジカルが関わる酸化反応より遅いため、最も多い分子種となる 1) 。McGill 大学の Krumova らは、ミトコンドリアが持つ連鎖的脂質過酸化反応を抑える機能を解析することを目的として、新しいプローブ開発を検討している 2) 。本稿ではミトコンドリア内膜の ROS の生成、蓄積、および消費の様子をリアルタイムにモニタリングするための蛍光性プローブを紹介する。
ミトコンドリア内膜の脂質ペルオキシルラジカルと特異的に反応する蛍光性プローブに要求される性質として ① 脂質ペルオキシルラジカルと選択的に反応すること ② 脂溶性かつミトコンドリア内膜に取り込まれること ③ 脂質ペルオキシルラジカルとの反応に応答して蛍光を発することが挙げられる。
Krumova らが開発したプローブ、Mito-Bodipy-TOH は反応基・蛍光団・ミトコンドリア指向性基の 3 つの部分から成る(Fig. 2)。
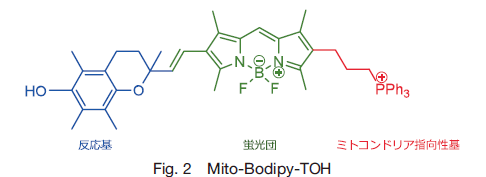
脂質ペルオキシルラジカルに対する反応基としてα- トコフェロールに類似した構造を持つクロマノールを選定した。α- トコフェロールは脂質ペルオキシルラジカルと選択的に反応する脂溶性抗酸化剤である。蛍光団には化学修飾しやすく、最適な蛍光特性を持ち脂溶性がある Bodipy が選定された。これにより脂質ペルオキシルラジカルとの反応の際、クロマノール部位が酸化されることで光誘起電子移動(photo-induced electron transfer: Pet )効果により蛍光発光する性質を有することになる。このとき、クロマノール部位と Bodipy 部を接続するビニル結合は反応基と蛍光団の距離を最小にとどめることで Pet に有利な条件にすると同時にプロ-ブに脂溶性を与える効果がある。そして、ミトコンドリア内膜への指向性を持たせるために、Murphy らが開発したトリフェニルホスホニウムカチオン(TPP)を使用した。TPP と Bodipy との結合部にアルキル鎖を使用することでミトコンドリア膜への導入を促進する効果を持たせた。
また、Mito-Bodipy-TOH の他にプローブの機能を評価するために、3 種類の化合物を調製している。その構造を Fig. 3 に、アセトニトリル中の吸収極大・極大蛍光波長および蛍光量子収率、モル吸光系数を Table 1 に示す。
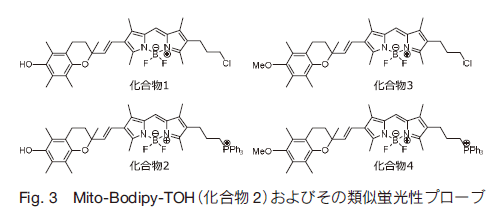

化合物 1 および化合物 2 (Mito-Bodipy-TOH)はクロマノールの水酸基をメトキシ基に置換した化合物 3、4 と比べ 10 分の 1 の蛍光量子収率であった。これは化合物 1、2 のクロマノール部位の Bodipy への Pet 効果により、蛍光強度が減少していることが示される。
次に Mito-Bodipy-TOH のペルオキシルラジカルとの反応性を評価するためにα-トコフェロールおよび類似の構造物である 2,2,5,7,8- ペンタメチル-6- ヒドロクロマン(PMHC)との共存下で均一系(アセトニトリル中)のペルオキシルラジカルとの反応性を調査した。結果、Mito-Bodipy-TOH は均一系においてα-トコフェロールやPMHC と同等の反応速度定数を有していることが確認された。これは Mito-Bodipy-TOH がα-トコフェロールと同等の脂質ペルオキシルラジカルに対する反応性を持つことを示す。また、リポソームを用いた評価では、親水性および脂溶性ペルオキシルラジカルによって 6 倍の蛍光強度増強がみられ、ペルオキシルラジカルに対する反応性も、α-トコフェロールと同等であった。
生細胞における Mito-Bodipy-TOH のミトコンドリアへの移行性を評価するために、化合物 2 (Mito-Bodipy-TOH)、3、4 を用いた。生細胞にはマウスの胚繊維芽細胞である NIH3T3 を用いた。NIH3T3 を 1μM の蛍光性プローブ(化合物 2, 3, 4)および 200 nM の MitoTracker Deep Red (市販のミトコンドリア標識剤)を用いて 37℃ で 5 分間染色しそれぞれの選択的波長で励起した。化合物 2 で染色した細胞は僅かな蛍光が見られ、MitoTracker Deep Red で染色した細胞は強い蛍光が見られる。Manders の手法 3) によりそれぞれの共局在係数を算出したところ、M1 = 0.998、M2 = 0.999 であり二つの蛍光物質がミトコンドリア内に共局在していることを確認した。同様に細胞染色により強い蛍光を発する化合物 4 と MitoTracker Deep Red が共局在していることが確認できた。一方、ミトコンドリア移行性基を持たない化合物 3 では MitoTracker Deep Red との共局在が認められなかった。この結果からトリフェニルホスホニウム基を持つ Mito-Bodipy-TOH はミトコンドリアへの移行性を持つことが確認できた。
Krumova らは生細胞内における Mito-Bodipy-TOH の酸化状態のモニタリング能力も評価した。 ROS 源としてメチルビオロゲン(MV2+)を用いることで、通常の生細胞および ROS を発生させた生細胞を調製した。そこに、Mito-Bodipy-TOH および MitoTracker Deep Red を加えた結果、MV2+ で処理していない細胞では Mito-Bodipy-TOH 添加によって蛍光強度の増大が認められなかったが、MV2+ 酸化によるストレスを受けた細胞の Mito-Bodipy-TOH の蛍光強度は 8 倍の蛍光強度の増大が認められた。これは MV2+ によって生成した脂質ペルオキシルラジカルと Mito-Bodipy-TOH が反応した結果を示している。
以上の結果から、Mito-Bodipy-TOH は先述の ①~③ の性質を満たし、生体試料中でのミトコンドリアの酸化状態をモニタリングすることが可能である。よって、Mito-Bodipy-TOH は脂質ペルオキシルラジカルに対する反応性と感度を備えた新しい蛍光プローブであるといえる。ミトコンドリア膜、タンパク質、および DNA に対する ROS の障害性はパーキンソン病、アルツハイマー病、筋萎縮性側索硬化症(ALS)、運動失調を含む神経変性疾患との関係性が取り沙汰されている。
生細胞のミトコンドリア内膜にてリアルタイムで ROS の生成、蓄積、および消費のモニタリングを可能にする非侵襲的イメージングの方法論は、ROS に関連する細胞病理の背後にある化学的メカニズムを解明するために極めて重要であるといえるため、Mito-Bodipy-TOH などのプローブを利用した研究の発展に注目したい。
▲ページのトップへ
参考文献
1) H. Yin, L. Xu and A. Porter, N. Chem. Rev., 2011, 111, 5944.
2) K. Krumova, L. E. Greene and G. Cosa, J. Am. Chem. Soc., 2013, 135, 17135-17143.
3) E. M. M. Manders, F. J. Verbeek and J. A. Aten, J. Microsc., 1993, 169, 375.
|