 |
| �@�g�b�v�y�[�W > �������f�ɂ���X B �זE�ی�@ Hydrogen sulfide protects pancreatic beta-cells from cell death |
 |
||||||||||||||||||||||||||
�������f�ɂ���X B �זE�ی�
|
||||||||||||||||||||||||||
 |
�ؑ��@�r�G �啪��w��w���w�����@�y���� |
 |
���{�@���O �啪��w��w�@��w�n�����ȁ@���m�ے� |
�v�|
�@Hydrogen sulfide was historically recognized to be a toxic gas generated by natural resources.�@However, intracellular enzymatic production of hydrogen sulfide as a metabolite of L-cysteine has been recently demonstrated in mammals. More attention has been paid to hydrogen sulfide as a potential intracellular messenger, because it participates in modification of long-term potentiation in the neural cells and relaxation of the smooth muscle cells.
�@We previously reported that the hydrogen sulfide donor NaHS inhibited glucose-induced insulin release from mouse pancreatic islets. Underlying mechanisms for the inhibition seems to be multiple. They include metabolic inhibition, opening of the ATP-sensitive K+ channel and other non-ionic events. We also demonstrated that NaHS and L-cysteine, a substrate for the hydrogen sulfide-producing enzymes, protected mouse islet cells from apoptotic cell death induced by high glucose or fatty acids, although they failed to influence ER-stress-induced islet cell death by thapsigargin or tunicamycin. NaHS increased total glutathione levels and decreased the production of reactive oxygen species in the mouse beta-cell line MIN6. Finally, we found that the expression of the hydrogen sulfide-producing enzyme cystathionine gamma-lyase �iCSE�j was induced by stimulation with glucose or anti-diabetic sulfonylureas in mouse islets. This supports an idea that hydrogen sulfide may be produced in an inducible manner just like the other two gasotransmitters nitric oxide and carbon monoxide. These findings also tempt us to suggest that hydrogen sulfide produced by CSE may be an intrinsic brake equipped within the pancreatic beta cell to inhibit insulin release and reduce cellular stress evoked by glucose and other insulin secretagogues, possibly via its anti-oxidant actions.
1�D �͂��߂�
�@1980 �N��Ɉ�_�����f���A�����Ĉ�_���Y�f���זE�����邢�͍זE�Ԃ̏���`�B���邱�Ƃ����炩�ɂȂ�A���b�Z���W���[�̊T�O�ɋC�̕��q������邱�ƂɂȂ����B�������f���V�O�i����`�B���邱�Ƃ́A�킪���̖ؑ��p�Y�i���E�������_�E�_�o��Ì����Z���^�[�j�ɂ���ď��߂Ē��ꂽ�B���ꂩ�� 15 �N���܂���o�āA�������f���� 3 �̃K�X�����b�Z���W���[�ł���Ƃ����F���Ɉ٘_��������l�͂��Ȃ��ł��낤�B����𗠕t����悤�ɁA�������f�̉e�����������_�����ŋ� 5 �N�ŋ}�����A�֘A����זE�@�\���_�o�`�B�E�؎��k���番�医�ہE�זE���ւƋ}���ȍL������݂��Ă���B�{�����ł́A����܂ł̒��҂�̌������ʂ𒆐S�ɁA�X B �זE�ɂ����闰�����f�̎Y���@�\�ƃC���X���������זE���ւ̉e�����T�����A�������f���זE���ʼnʂ��������ɂ��ċc�_����B
�Q�D �V�O�i�����q�Ƃ��Ă̗������f
�@�������f�́A�Â���莩�R�E�ŎY�������L�ŃK�X�Ƃ��ĔF������Ă����B���ہA�n���J�ƌĂ��n���z�R�Ȃǂł͓ŃK�X�ɂ�鎖�̂̋L�^���c���Ă��邪�A���̃K�X�̎�v�ȗL�Ő����͗������f�ł���B�������f�̎Y�����́A���R�E�����ł͂Ȃ��B�ߑ�ɂȂ��Ă���́A���w�H���S�~������Ȃǐl�דI�Ȕ���������Y������邱�Ƃ��m���Ă���B�������f�̓Ő��͋ɂ߂ċ����A�ċz�����\������y�f��j�Q���邱�ƂŎ��Ɏ��炵�߂邱�Ƃ����Ȃ��Ȃ��B����ŁA���̃K�X�͗������f��̌��\�ɋ�������悤�ɁA���N�𑣐i�����ʂ��������킹�Ă���B
�@�������f�����̓��ŎY������Ă��邱�Ƃ́A���̃K�X�ɂ�钆�ł̌����ɒ[���Ă���B 1989 �N�A�]���ɍ��Z�x�̗������f�����݂��Ă���\�����������ꂽ 1�j�B 1996 �N�ɂ́A�������f���C�n�_�o�זE�ɂ����� NMDA ��e�̂̃V�O�i�������邱�ƂŁA���������𑣐i���邱�Ƃ����ꂽ 2�j�B�������f���זE���ŃV�O�i�����q�Ƃ��ē����Ă��邱�Ƃ��F�����ꂽ�킯�ł���B�����ŁA�������f��������o�ɂ����邱�Ƃ����ꂽ 3�j�B���݂ł́A�������f����_�����f���_���Y�f�Ɏ����� 3 �̃K�X�����b�Z���W���[�ł��邱�Ƃ��L��������Ă��� 4�j�B
�@���̓��̗������f�́A���� 4 ��ނ̎Y���y�f�ɂ���Đ��䂳��Ă���ƍl�����Ă���B CBS �icystathionine beta-synthase�j�͔]�ɂ������v�ȗ������f�Y���y�f�Ƃ��ē��肳��A�O�q�̊C�n���������Ɋւ���Ă���B���݂ł́A�]�ȊO�ɐt����̑��ɔ������邱�Ƃ��킩���Ă���B CSE �icystathionine gamma-lyase�j�͕����ɂ����闰�����f�̎Y�����Ƃ��ē��肳��A�o�ɍ�p�𐧌䂵�Ă���B CSE �́A�]�������t����̑��Ȃǂ������̑g�D�ɔ������Ă���B CAT �icysteine aminotransferase�j�� 3-MST �i3-mercaptopyruvate sulfurtransferase�j�͊C�n���]�玿�̐��̍זE�Ȃǂ̐_�o�זE�⌌�Ǖ����ɔ������A2 �̍y�f�������I�ɓ������Ƃŗ������f���Y������B�����̍y�f�́AL- �V�X�e�C������Ƃ��Ă���ACBS �� CSE �͍זE���ɁA3-MST �͍זE���ɉ����ă~�g�R���h���A�̃}�g���b�N�X�ɋǍ݂��Ă���B�ŋ߁AD- �V�X�e�C�����痰�����f��������V�K�o�H���t���Ŕ������ꂽ 5�j�B���̌o�H�ł́ADAO �iD-amino acid oxidase�j�� 3-MST �������I�ɓ������ƂŁA���]��t���ŗ������f���Y������B���ɁA�t���ł� D- �V�X�e�C���� L- �V�X�e�C���ɔ�ׂ� 80 �{�����悭�������f�����邱�Ƃ��킩��A��Âւ̉��p�����҂���Ă���B�܂��A�������f�͊e�g�D�̎Y���y�f�ɉ����āA�����ۂɂ��Y������邱�Ƃ��m���Ă���B�������f���K�X�����b�Z���W���[�ł��邱�Ƃ���A���ӑg�D�ւ̉e�������邱�Ƃ͂ł��Ȃ��B��q�� 4 ��ނ̍y�f�́A�������ꕔ�I�[�o�[���b�v���Ă���B���̂��߁A�e�y�f�̗������f�Y���\�̈Ⴂ��e�g�D�ɂ������^�ɂ��ẮA����Ȃ��͂��K�v�ł���B
�R�D �C���X��������}������
�@���A�a�̓C���X�����̌��R����э�p�s�S�������S�g���̑�ӎ����ł���B�䂪���̓��A�a�̑唼���߂� 2 �^���A�a�ł́A�X B �זE����̃C���X���������Q�ƃC���X�����W�I�זE�ɂ�����C���X������R�����l�X�Ȋ����œ���܂����Ă���B���ɁA���{�l�̓��A�a���҂ł͑O�҂̐�߂銄�����傫�����Ƃ��Տ��I�Ȍ������疾�炩�ɂ���Ă���B�C���X�����́A�����̃O���R�[�X�Z�x���Ȃ킿�����l�̈ێ��ɏd�v�ȃz�������ŁA�X���̃����Q���n���X���i�X���j�ɑ��݂����X B �זE���番�傳���B�זE���ō������ꂽ�C���X�����́A�������ɕ�܂ꂽ��ɍזE���ߖT�֗A�������B�O���R�[�X�h���́A�זE���J���V�E���C�I���Z�x�̏㏸������������ƍזE���̗Z���𑣐i���A�C���X�������זE�O�ɕ��o����B
�@�C���X��������߂���h�{�����ɂ́A���ނ�A�~�m�_�A�����Ȃǂ���������B�����̕����ŕ���}�����ʂ������̂͋ɂ߂ď��Ȃ��A�Ȃ��ł���ӂ���邱�Ƃɂ���ĕ����}�����镨���́A�قƂ�ǒm���Ă��Ȃ��B�M�҂�́A��K�{�A�~�m�_�ł��� L- �V�X�e�C���������̌o�H����āA�X B �זE����̃C���X���������}�����邱�Ƃ����������� 6�j�B L- �V�X�e�C���ɂ�镪��}���́A���O���R�[�X�ɉ����ăX���z�j���A�f���P�g�C�\�J�v�����_�A���J���E���E���ɂɂ�镪��h�������ł��݂�ꂽ�B����ɁAL- �V�X�e�C���ɂ�镪��}�����ʂ́A�זE���ߐ����������זE�ł�����ꂽ�B����ɁAL- �V�X�e�C�����זE���� ATP �Y����}�����邱�Ƃ��A���V�t�F�����E���V�t�F���[�[�@�� Rhodamine123 ��p�����~�g�R���h���A���d�ʑ����薾�炩�ɂ����B�܂��A�O���R�[�X�ɂ���Ă�����J���V�E���C�I���̃I�V���[�V������ L- �V�X�e�C�����}�����邱�Ƃ����Ă���B
�@�M�҂�́AL- �V�X�e�C���̌��ʂ��������Ă����ߒ��ŁA���̃A�~�m�_���班�Ȃ��Ƃ������I�ɂ͗������f���Y������A�C���X���������}�����邱�Ƃ𖾂炩�ɂ��� 6�j�B�������f�h�i�[�ł��� NaHS �́AL- �V�X�e�C���ł݂�ꂽ�}�����ʂ��Č������B����ɁA�X B �זE�ɗ������f�Y���y�f���������Ă��邱�ƁAL- �V�X�e�C�������ɂ���X B �זE���ŗ������f���Y������邱�Ƃ������������B�������f�́A��ӂɂ�� ATP �Y���̗}����זE���J���V�E���C�I���̓��ԂɈˑ������ɃC���X���������}������o�H�������Ă��邪 6-8�j�A���̏ڍׂȋ@�\�Ɋւ��Ă͍���̌����ɂ䂾�˂��Ă���B
�S�D �X B �זE�ی����
�@�������f�́A���Ǖ����̒o�ɂ�_�o�`�B�̒��߂ɉ����āA�זE���̎�N��}���ɂ��ւ���Ă���B��N�Ɨ}���́A�זE��g�D�A�퍷�ɉ����āA�������f�̔Z�x�⏈�u�@�A�זE��Q�̎�ނɂ���Č��܂��Ă���ƍl�����Ă���B����́A�������f���ٓI�Ȑ����ł͂Ȃ��B�������f����s���Ă����_�����f�̌����ł́A�Z�x�̈Ⴂ�ɂ�葊��������ʂ��������u��ʐ��̍�p�v������Ă���B
�@�M�҂�́A�}�E�X�X���ƃ}�E�X�|�{�X B �זE MIN6 ��p���āA���O���R�[�X�ɂ���ėU��������X B �זE���ɗ������f���y�ڂ��e������������ 9�j�B L- �V�X�e�C���� NaHS �́A���O���R�[�X�ŗU��������X B �זE����}�������i�} 1�j�B����ɁAL- �V�X�e�C���ɂ��זE���̗}���́ACSE �j�Q�� PPG �̑��݉��ł݂͂��Ȃ������B�܂��A���̗}���ɂ͍זE���̃O���^�`�I���̑����⊈���_�f��Y���̗}�����֗^���Ă��邱�Ƃ��������B�X���@�\�ւ̉e���������������ʂ���́A�זE���̗}���͍��O���R�[�X�ɂ��C���X��������\�̒ቺ�����P���A�X B �זE��ی삷�邱�Ƃ��킩�����B

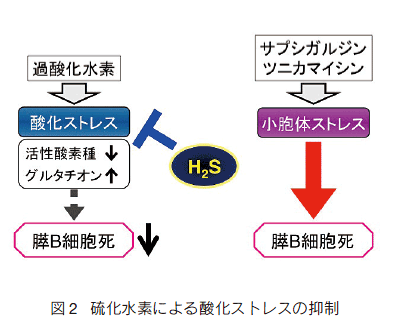
�@�������f�ɂ���X B �זE�ی�́A�O���R�[�X�h���ɓ��ٓI�ł͂Ȃ��i�} 1�j�B�������f�́A�p���~�`���_��T�C�g�J�C���A�ߎ_�����f�ŗU�������זE���ɂ����l�̗}�����ʂ������� 10�j�B����A���E�̃X�g���X��U������T�v�V�K���W����c�j�J�}�C�V���ɂ���X B �זE���ɂ͉e�����y�ڂ��Ȃ������i�} 2�j�B�������̌��ʂ́A�������f���_���X�g���X�����X B �זE��ی삷�邪���E�̃X�g���X�ɂ͉e�����y�ڂ��Ȃ����Ƃ������Ă���B���̕ی��p�́A�O�q�̍זE���O���^�`�I���̑���������R�_����p�ɉ����āA�זE�ی�I�ɓ����v���e�C���L�i�[�[ Akt �̊���������Ă���B����AYang �����́A���b�g�C���X���m�[�} INS-1E ��p�������� ���A���Z�x�̗������f�����E�̃X�g���X������זE�������� �N�������Ƃ���Ă��� 11�j�B���̍��ق́A�X B �זE�ɂ����闰�����f�̓�ʐ��������Ă���ƍl������B
�T�D �U�����������f�Y���y�f CSE
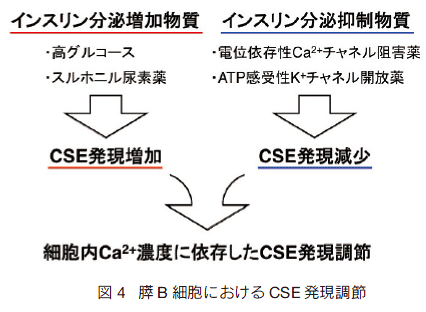
�@�g�D��זE��ɂ���āA�@�\���Ă��闰�����f�Y���y�f�͈قȂ��Ă���B�M�҂�́A�������f�̃C���X��������}�����ʁi�������f�̒Z���I���ʁj�ׂĂ���ߒ��ŁA�X B �זE�ɂ� CBS �� CSE ���������Ă��邱�Ƃ𖾂炩�ɂ��� 6�j�B���̌�A�������f�̍זE�ی���ʁi�������f�̒����I���ʁj����͂���ߒ��ŁA���O���R�[�X�Œ����Ԕ|�{�����X���� CSE �̔������㏸���邱�Ƃ����������� 9�j�B�����ߒ��ŗ������f�Y���y�f���U������邱�Ƃ͊��ɒm���Ă��� 12,13�j�B�܂��A��X�e���C�h���R���ǖ�iNSAID�j���ݔS���זE�� CSE �̔�����}����������� 14�j�B�������A�O���R�[�X�Ƃ��������I�ȕ������������f�Y���y�f�̔�����U�����邱�Ƃ��������́A�M�҂�̘_�������߂Ăł���i�} 3�j�B�����[�����ƂɁA�X B �זE�ŕی���ʂ��������̂́A�����U�����ꂽ CSE ����̗������f�ł����� 9�j�B�����Ԕ|�{�ɂ�� CSE �̔����㏸�́A���O���R�[�X�ɉ����ăX���z�j���A�f��ł��݂�ꂽ���A�j�g�����W�s����W�A�]�L�V�h�A�}���m�w�v�c���[�X�ł݂͂��Ȃ����� 15�j�B�܂�A�C���X�����������N���镨���Œ����Ԕ|�{�����X B �זE�ɂ����āACSE �̔������U������邱�Ƃ����炩�ɂȂ����킯�ł���i�} 4�j�B

�@�M�҂�́A�U�����������f�Y���y�f CSE �ɒ��ڂ��A���̔�������@�\�̉�͂��s���� 15�j�B�C���X���������N�����ɂ��זE���J���V�E���C�I���Z�x�̏㏸�́ACaM �L�i�[�[�U ����� MAP �L�i�[�[�o�H�������������i�} 5�j�B���̌��ʁA�]�ʈ��q�� SP1 �� Elk1 �������_�����ꂽ�B����ɁA2 �̓]�ʈ��q�����V�t�F���[�[���|�[�^�[�A�b�Z�C�ɂ��]���������ʁASP1 �͓]�ʒ��ߗ̈�ɒ��ڌ������� CSE �̔����𑣐i���邪�AElk1 �͊ԐړI�Ȑ�����s�����Ƃ𖾂炩�ɂ����B�O���R�[�X�ɂ�� SP1 �̃����_���́AMIN6 �ɉ����� INS-1E �ł��m�F����Ă��� 16�j�B

�@�C���X�����������N����O���R�[�X�Œ����Ԗ\�I���ꂽ�X B �זE�́ACSE �̗U������čזE���̗������f�Y���𑣐i����B�Y�����ꂽ�������f�́A�Z���I�ɂ̓C���X���������}�����A�����I�ɂ��X B �זE��ی삷��B�M�҂�́A�������f�Ƃ͔敾�����X B �זE�̊����i�C���X��������j�������邱�ƂŁA�����I�ȍ��O���R�[�X�ɂ���Q���玩�g����邽�߂̕ی���q�iintrinsic brake�j�ł���ƍl���Ă���i�} 6�j�B

�U�D������
�@�{�����ł́A����܂ł̕M�҂�̌����𒆐S�ɁA�X B �זE�ɂ����闰�����f�̋@�\�ɂ��ďЉ���B�������f�̃C���X��������}�����ʂ͈ꌩ�A���A�a���Ö�ւ̉��p����͊O��Ă���悤�Ɍ�����B�������Ȃ���A���̗}�����ʂ��X B �זE���I�ȍ������ɂ���Q�����邱�Ƃ͋����[���B�M�҂�͌��݁A�̃��x���̉�͂��s�����߂� CSE �m�b�N�A�E�g�}�E�X�ɂ�����ϓ��\�ُ�ɂ��Č������s���Ă���B�܂��A���ʂ̓s����A����͏Љ�ł��Ȃ��������ACSE ����Y�����ꂽ�������f�ɂ��זE�ی�@�\�q���x���ʼn�͂��邽�߂ɁA���̃^�[�Q�b�g���q�̖ԗ��I�ȉ�͂��s���Ă���B�����̌����ɂ��Ă��A�߂������ɕł��邱�Ƃ����҂��Ă���B
�V�D�ӎ�
�@�{�����́A�啪��w��w�� �̐m�؈�Y�����A���_�E�_�o��Ì����Z���^�[ �ؑ��p�Y�����A������w��w�� �R�{�G�K�����A���c�ی��q����w��w�� ����R�I�v�����A�啪��w��w�� ��q�������A�c��`�m��w��w�� �Έ���y�����A�k����w��w�� �����N�m�u�t�A�É�������w��w�� ���q��q�����Ƃ̋��������ɂ����̂ł��B�܂��A�{�����𐄐i����ɂ�����啪��w��w���w�����̊w�������̂����͂����Ƃ����Ӓv���܂��B �{�����̈ꕔ�́A�����Ȋw�ȉȊw������iC�j�y�сA�啪���������U�����c�̎x���ɂ��s���܂����B
| ���҃v���t�B�[�� | |
| ���� | �ؑ��@�r�G |
|---|---|
| ���� | �啪��w��w���w�����@�y���� |
| �A���� | �� 879-5593�@�啪���R�z�s�p�Ԓ���傪�u 1-1 TEL �F 097-586-5722�@FAX �F 097-586-5729 E-mai l �F t-kimura@oita-u.ac.jp |
| �w�� | ���m�@�i��w�j ���É���w��w�n�����ȁ@�_�o���w�u���i�L���O�O�����j |
| ���� | 2005 �N�@���É���w��w�n�����Ȕ��m�ے��C�� 2005 �N�@�啪��w��w���@�w�����@���� 2007 �N�@�啪��w��w���@�w�����@���� 2010 �N��茻�E |
| �����e�[�} | �������f�ɂ���X B �זE�ی�@�\�̉�́AGDP �^
G �^���p�N���V�O�i�����O�̉𖾁A����}�V�i���[�̃��T�C�N�����O�@�\�̉�� �@�����̂�����́AE-mail �Ŗ₢���킹�����Ă��������B��w�@�����L����W���Ă��܂��B |
| �z�[���y�[�W | http://www.med.oita-u.ac.jp/pharmacology/ |
| � | �h���C�u�A�����j���O�A�e�j�X |
| ���� | ���{�@���O |
|---|---|
| ���� | �啪��w��w�@��w�n�����ȁ@���m�ے� |
| ���� | 2003 �N 3 ���@�啪��w��w����w�ȑ��� 2010 �N 4 ���`�@�啪��w��w�@��w�n�����Ȕ��m�ے��@�ݐ� |
| � | �X�|�[�c�ϐ�A�o�h�~���g���A�t�b�g�T�� |
| Copyright(c) 1996-2013 DOJINDO LABORATORIES,�@ALL Rights Reserved. |