 |
| トップページ > 新しい細胞死ネクロトーシス ~プログラムされたネクローシス~ |
 |
||||||||||||||||||||
新しい細胞死ネクロトーシス ~プログラムされたネクローシス~
要旨 Apoptosis has been considered the form of programmed cell death, whereas necrosis is regarded as unregulated and non-programmed cell death. The accumulating evidence revealed that necrosis can occur in a regulated manner, which was termed as “necroptosis”. We found that 24(S) -hydroxycholesterol(24S-OHC)which was one of oxysterols converted from cholesterol enzymaticaly in the brain induced neuronal cell death by necroptosis. Neuronal cells treated with 24S-OHC did not exhibit any of features of apoptosis, whereas they showed morphological changes like necrosis. The neuronal cell death induced by 24S-OHC was dependent on receptor-interacting serine/threonine kinase 1(RIPK1)required for necroptosis. There have been many reports showing that reactive oxygen species(ROS) are involved in necroptosis. We confirmed that ROS were not involved in 24S-OHC-induced necroptosis by showing that neither ROS generation nor lipid peroxidation was induced in 24S-OHC-treated neuronal cells. はじめに20 世紀の後半まで細胞死に関するわれわれの認識はかなり画一的であった。たとえば毒蛇や毒蜘蛛などの毒素の作用により細胞が死んでいく様を表わし、これを “壊死” と呼んでいた。そして、病理組織標本で観察される死んだ細胞の痕跡をまた “壊死” といい、病理学においてはこれとほぼ同義語として“ネクローシス”という言葉が用いられてきた。 20 世紀の後半に入って、多細胞生物が正常な発生や恒常性の維持のために、必要に応じて特定の細胞を細胞死に導く機構を備えていることがわかり(プログラムされた細胞死)、われわれの細胞死に対する考え方や捉え方は大きく変化した。 “アポトーシス” という言葉が使われるようになり、プログラムされた細胞死に関する研究は大変な勢いで進んだ。しかしその一方で、細胞死について混乱や誤解が生じている場合も少なくない。そして 21 世紀に入ってもなお、新しい細胞死の存在が報告されている。本稿では、まだ議論のあるところや、充分解明されていない部分も含めて、細胞死についてその概念とわれわれの認識の変遷をまとめた上で、近年提唱された細胞死 “ネクロトーシス” について概説する。 アポトーシスとネクローシス細胞死の種類について分類し、それぞれの生理学的、病理学的意味がさかんに議論されるようになったのは、1972 年に Kerr らによって “アポトーシス:プログラムされた細胞死” が報告されてからである 1)。実は、その数年前に、プログラムされた細胞死の存在はすでに確認されていたが 2)、やはり注目されるようになったのは、アポトーシスという言葉とともにその概念や特徴についての報告がされて以降になる。細胞死の形態学的分類が Schweichel らによって初めておこなわれたのは、翌年 1973 年のことで、このときは、細胞死は TypeⅠ“heterophagy”、Type Ⅱ “autophagy”、そして Type Ⅲ “without digestion”の 3 種類に分けられた 3)。これらは後に、アポトーシス、オートファジー(autophagic cell death)、そして、ネクローシスに相当するものとして改めて認識されることになる 4)。 アポトーシスとネクローシスの最も重要な違いは、前者がプログラムされた細胞死で、後者がプログラムされていない細胞死という点であろう。言い換えれば、アポトーシスは制御可能であるが、ネクローシスは制御困難ということになる。これは医学的に大変魅力のある概念で、遺伝子レベルでプログラムされている細胞死のメカニズムがあるならば、そのメカニズムを知ることによって細胞死を制御して疾患の発症や進行を抑制することができることを意味している。このため、アポトーシスを誘導する化合物(刺激)、それを受け取る細胞の受容体、遺伝子発現やタンパク質合成に関係するシグナル伝達等々、アポトーシスに至るメカニズムについてさかんに研究されて多くのことが明らかになってきた。アポトーシスの形態学的な特徴はネクローシスとの対比において明確に示されている(表 1)。それぞれの特徴を模式的に図 1 に表わした。 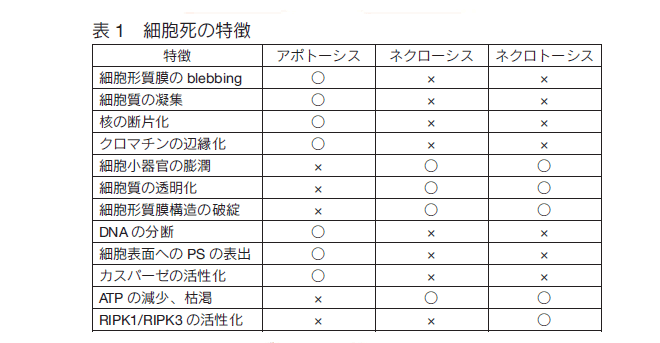  アポトーシス細胞は、細胞膜表面の突出(blebbing)、細胞質の凝縮、核の断片化、そして核のクロマチンの辺縁化などがみられる。ネクローシス細胞では、細胞小器官の膨潤、細胞質の透明化、核の凝縮、そして細胞膜の破綻などが観察される。これら形態学的な特徴に加えて、生化学的、細胞生物学的アプローチにより、アポトーシスとネクローシスの特徴が明らかにされている(表 1)。アポトーシス細胞では、 DNA の分断、細胞膜表面へのホスファチジルセリン(PS)の表出、そして種々のカスパーゼの活性化がおこる。アポトーシスを誘導する多くの種類の化合物が知られており、活性化されるカスパーゼの種類も異なる 5)。アポトーシスについては他の総説に詳しいので参照いただきたい 6)。ネクローシスの細胞ではこれらの特徴は見られず、その一方で、ネクローシス細胞では細胞内の ATP が減少するが、アポトーシスでは減少はみられないとされている 7)。アポトーシスとネクローシスは形態(構造)的、機能的両面において対比して論じられ、それぞれ、プログラムされた細胞死とプログラムされない細胞死の代名詞のように捉えられてきたといってよいだろう。 ネクロトーシスオートファジーに関する研究とは別に、「プログラムされた細胞死=アポトーシス」 「プログラムされない細胞死=ネクローシス」という分類に疑問を呈する実験結果が報告された。TNFα はこれに対する受容体もわかっており、アポトーシス研究によく用いられていた。 Laster らは細胞を TNFα で処理して細胞死を誘導した場合、細胞の種類によってアポトーシスの形態を示すものとネクローシスの形態を示すものがあることに気づいた 10)。この発見はネクローシスがただ単に偶発的に起こるものであるという概念を揺るがすものであった。これに続くいくつかの報告は “プログラムされたネクローシス” という概念を生み出すことになり 11)、そして、2005 年に Degterev らによって、この細胞死に “ネクロトーシス” という名前が付けられた 12)。 2005 年以降、ネクロトーシスに関する論文の数は急速に増加し続けている(図 2)。 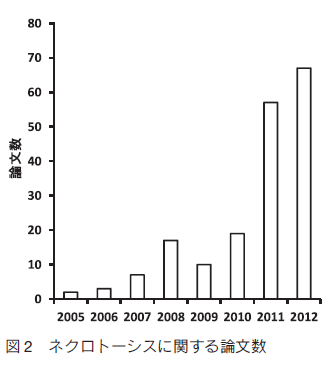 ネクロトーシスは形態学的にはネクローシスとほぼ同様の特徴を示す。表 1 に示すように、細胞膜構造は破綻し、核の凝縮がみられる。一方、アポトーシスにみられる細胞膜表面の blebbing、細胞質の凝縮、核の断片化などはみられない。そして、DNA の分断、細胞膜表面へのホスファチジルセリンの表出、そして種々のカスパーゼの活性化もおこらない。ヒトの T 細胞由来の Jurkat 細胞を TNFα で刺激すると、細胞はアポトーシスをおこして細胞死に至ることはよく知られており、そのメカニズムも詳細に調べられている 7)。図 3 に示すように、TNFα が細胞の TNFα 受容体に結合すると、RFK (riboflavin kinase)を介して TRADD (TNF receptor-associated death domain),TRAF2 (TNF-receptor-associated factor 2),TRAF5,そして RIPK1(receptor interacting protein kinase 1 ; RIP 1 と表わされることもある)などからなる complexⅠが形成される。これらのタンパク質はポリユビキチン化されているが、A20 (TNFIP3),cezanne(OTUD7B) そして USP21 (ubiquitin specific peptidase)などの働きによって脱ユビキチン化されると、RIPK1 は complexⅡの形成に移行する。 ComplexⅡ は RIPK1,RIPK 3,Fas-associated protein with a death domain(FADD),TRADD そして caspase 8 で構成される。 Complex Ⅱ の caspase 8 が活性化している状態にあると RIPK1 と RIPK 3 は活性を失い、カスパ ーゼ依存性の細胞死 “アポトーシス” がおこるしくみになっている。このとき、カスパーゼ全般を抑制する試薬である zVAD (benzyloxycarbonylvalyl-alany-laspartyl fluoromethyl ketone)で細胞を処理しておくと、細胞はネクローシス様の細胞死 “ネクロトーシス” をおこす 12)。この過程には RIPK1 の活性化が重要であることが示されている 12)。 RIPK1 が活性化して自己リン酸化すると RIPK 3 をリン酸化して活性化することはそれ以前にも報告されていた 13, 14)。カスパーゼを阻害すると細胞はネクローシス様の形態をとって細胞死を起こすことは別のリンパ球系の細胞 L929 でも確認されている 15)。しかし、RIPK1/RIPK 3 の活性化からネクロトーシスがおこるまでのメカニズムについては様々な報告があり、まだよくわからない部分も多い。 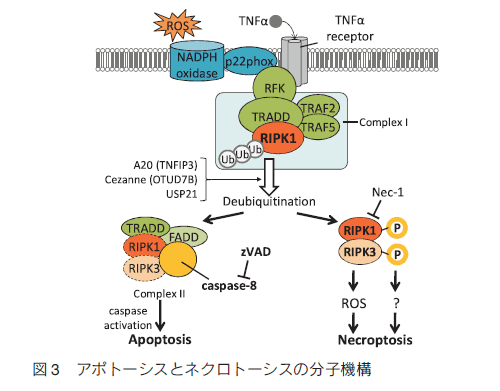 神経細胞のネクロトーシスわれわれの研究室では、神経変性疾患の発症メカニズムにおける酸化ストレスの関与に注目して研究をおこなってきた。神経変性疾患は神経細胞死が主な原因となって発症する。また、神経変性疾患と脂質代謝の関連については注目されているものの、まだその詳細は明らかにされていない。われわれはここに着目し、コレステロールの酸化と細胞死の関係について研究を始めた。脳のコレステロール代謝は他の臓器とは異なる特殊な環境に適応したメカニズムによって制御されている。脳以外の組織では、コレステロールは細胞内の生合成と食餌由来のコレステロールの両方から供給される。食餌性コレステロールはリポタンパク質に組込まれて各臓器・組織に運ばれ、逆に細胞内の過剰なコレステロールはリポタンパク質に引き抜かれて血液循環系に戻る。しかし、リポタンパク質は血液脳関門を通ることができないため、脳はリポタンパク質からコレステロールの供給を受けることはできない 16)。 そこで、脳の細胞はもっぱらコレステロール生合成を行うことによりコレステロールレベルを維持しているが、濃度が過剰になった場合に、コレステロール自身もまた血液脳関門を通過できないため、血液循環系に戻すことができない 17)。そこで生体は、脳の細胞だけにコレステロール 24S ヒドロキシラーゼ(CYP46A1)という酸化酵素を発現して、血液脳関門を通過できる 24(S)-ヒドロキシコレステロール(24S-OHC) を産生するしくみを備えて適応している(図 4)。脳で過剰になったコレステロールは 24S-OHC に変換されて血液循環系に排出される 18)。 24S-OHC は また、核内受容体の LXR(Liver X Receptor)のリガンドや SREBP2 (Sterol Regulatory Element-Binding Protein 2)の活性化抑制因子として働くことにより、細胞の脂質代謝制御に関わっていることが知られている 19, 20)。  その一方で、アルツハイマー病(AD)の発症に 24S-OHC が関わることが示唆されている。たとえば、患者の血漿や脳脊髄液で、 24S-OHC の上昇がみられる 21 ,22)、AD 患者の脳に観察される老人斑の周囲に CYP46A1 が高発現している 23)、そして AD 患者に CYP46A1 の活性亢進変異が見られる 24) などである。 24S-OHC が神経細胞毒性を示すことも知られていたが、そのメカニズムの詳細は不明であった 25)。  24S-OHC による細胞死は細胞によってアポトーシスであったりネクロトーシスであったりするが、いずれにしてもプログラムされた細胞死である。 24S-OHC が細胞に最初にどのように作用するのか、受容体を介するのか、細胞膜の構造に変化を与えるのか、あるいは細胞膜を通過して細胞内に入るのか、そして RIPK1 をどのようにして活性化させるのかなど、今後の研究課題である。 ネクロトーシスシグナルへのROSの関与 RIPK1/ RIPK3 活性化以降のシグナル伝達に、活性酸素(ROS ; reactive oxygen species)が重要な役割を担っていることが報告されている 7)。 TNFα 刺激によるネクローシス様の細胞死において、ミトコンドリアの呼吸鎖 complexⅠからの ROS 産生が重要であることを最初に示したのは Fiers らのグループである 27) 。その後ネクロトーシスにおける ROS 産生のメカニズムについて多くの報告がなされてきた。活性化した RIPK3 は PYGL (glycogen phosphorylase),GLUL (glutamate-ammonia ligase),GLUD1 (glutamate dehydrogenase 1)などの代謝酵素と物理的に相互作用をしてアロステリックにこれらの酵素を活性化させる。 zVAD 存在下で細胞を TNFα で刺激するときに、これらの酵素の遺伝子を siRNA でノックダウンすると、 ROS の産生もネクロトーシス細胞死も抑制されることが示されている 28)。また、RIPK1/ RIPK3 活性化は細胞質内のカルシウム濃度を上昇させ、phospholipase A2 を活性化させ、リン脂質から遊離の脂肪酸の切り出しを促進する結果、lipid peroxidation が起るとされている 29)。 TNF 受容体に TNFαが結合すると、RFK が細胞死シグナルの complexⅠ 形成に重要な働きをすることは図 3 の説明で述べた。このとき、RFK は TRADD と NADP Hoxidase のサブユニットである p22phox との間を架橋し NADPH oxidase を活性化してスーパーオキサイドの産生を促す 30)。ミトコンドリアや NADPH oxidase により産生されるスーパーオキサイド(O2・-)は SOD(superoxide dismutase)により過酸化水素(H2O2)に還元されるが、鉄や銅などの遷移金属が存在すると、Fenton 反応によって最も攻撃性の高いヒドロキシラジカル(HO・)やヒドロペルオキシラジカル(HO2・)が生じる。これらフリーラジカルによって脂質やタンパク質の酸化が開始されると、ラジカル連鎖反応がおこり多くのヒドロペルオキシドが産生される。これらがネクロトーシスの誘発に重要との見方がある  今後の展望神経細胞は免疫細胞とは異なり、caspase 8 の発現を抑えてアポトーシスが起こりにくいしくみになっている。それでもあえてネクロトーシスによって細胞死に導く機構を備えていることが明らかになってきたわけであるが、その病態生理学的意味は今後解明されなければならない。脳で特異的に産生される 24S-OHC が誘導する細胞死メカニズムについては、まだ不明な点が残されている。しかしながら、24S-OHC が RIPK1 の活性化を介してネクロトーシスを誘導することは、少なくともこの細胞死を制御できる可能性を示唆している。今後、24S-OHC の RIPK1 活性化メカニズムを含めて、24S-OHC によるネクロトーシスのメカニズムの詳細を明らかにすることにより、24S-OHC が関与する神経変性疾患の治療へ一歩近づくことができるのではないかと期待している。 |
||||||||||||||||||||
|
||||||||||||||||||||
| Copyright(c) 1996-2012 DOJINDO LABORATORIES, ALL Rights Reserved. |

