 |
| トップページ > 「蛍光生物学」の最前線 5-1 |
 |
|||||||||||||||||||||||||||
「蛍光生物学」の最前線 5-1
1.はじめにGFP 蛍光タンパク質の生物学への応用は、単に分子や細胞のマーカーとしての利用に留まらず、分子活性や細胞機能をモニターするバイオセンサー群の開発へと発展している。なかでもフェルスター(又は蛍光)共鳴エネルギー移動 (Förster/fluorescence resonance energy transfer、FRET)の原理に基づくバイオセンサーは、イオン濃度、情報伝達分子群の活性、さらには脂質や糖の濃度を測定することができ、生物の様々な状態をリアルタイムに観測するツールとして幅広く使われるに至っている。最近の FRET バイオセンサーの注目すべき進歩としては、その種類が格段に増加したこと、 FRET バイオセンサーに至適な蛍光タンパク質が開発されたこと、高感度化のためのプラットフォームができたこと、安定発現培養細胞株が容易に作製できるようになったこと等が挙げられる。本稿では、 FRET バイオセンサーの原理および種類を俯瞰したのちに、最近の進歩について解説する。 2. FRET バイオセンサーA) FRET の原理フェルスター共鳴エネルギー移動 ( Förster resonance energy transfer、FRET)とは、励起状態のドナー分子から、近傍のアクセプター分子にエネルギーが無放射遷移する現象を指す 1) 。生物学研究においては、蛍光分子をドナー分子として用いることが多いために、蛍光共鳴エネルギー移動 (Fluorescence resonance energy transfer)が訳語として用いられることが多い。ちなみに、ルシフェラーゼなどの生物発光分子をドナーとして用いる場合は、生物発光共鳴エネルギー移動 (Bioluminescence resonance energy transfer, BRET)と呼ばれる。本稿では、 GFP 蛍光タンパク質を用いた FRET バイオセンサーについて主に解説するので、ドナー分子もアクセプター分子も蛍光タンパク質の場合について記載し、それ以外の FRET については説明を割愛する。 1 ドナー分子あたりに FRET が生じる確率、つまり FRET 効率は、① ドナーとアクセプター蛍光タンパク質間の距離、② ドナーとアクセプター蛍光タンパク質の蛍光発色団の相対的向き、③ ドナー蛍光タンパク質の発光スペクトラムとアクセプター蛍光タンパク質の吸収スペクトラムのオーバーラップ、これらの 3 つの因子によって主として決定される。前二者の違いを図 1a,b に概念的に示す。 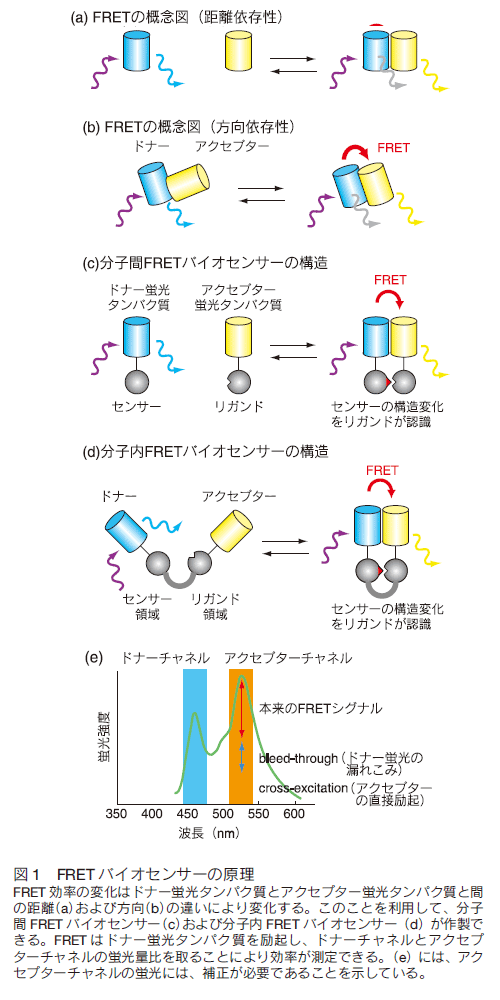 B) FRET バイオセンサーの構造蛍光タンパク質からなる FRET バイオセンサーは一般的にアクセプター蛍光タンパク質、ドナー蛍光タンパク質、リガンド領域、センサー領域、そしてこれらを結合するリンカー領域から構成される。センサー領域は、外部環境変化により構造が変化する部位である。たとえば、リン酸化、GTP 結合、あるいはイオンやリン脂質の結合などが、このセンサー領域の構造変化をもたらす環境変化として代表的なものである。生体内には、このようなタンパク質の構造変化を識別して特異的に結合できる多くのタンパク質ドメインが存在しており、これらがリガンド領域として用いられる。リン酸化チロシンを認識する SH2 ドメイン、リン酸化セリン/スレオニンを認識する FHA1 ドメインや WW ドメインなどが代表例である。外部環境変化に対応したセンサー領域の構造変化がリガンド領域への結合をもたらす際に、アクセプター蛍光タンパク質からドナー蛍光タンパク質への FRET 効率が変化することを利用して FRET バイオセンサーは作製される。リンカー領域はこれらの構成因子をつなぐ部分である。 C) 分子間型 FRET バイオセンサーFRET バイオセンサーは、大きく分子間型(二分子型)と分子内型(一分子型)に分けられる2) (図 1 c,d )。分子間型 FRET バイオセンサーは、アクセプター蛍光分子を含むバイオセンサーと、ドナー蛍光タンパク質を含むバイオセンサーの 1 セットから成る(図 1 c)。それぞれに、リガンドあるいはセンサー領域が含まれており、この二者の結合がドナー蛍光タンパク質とアクセプター蛍光タンパク質との近接化をもたらし、結果として FRET 効率が上昇する。この分子間型 FRET バイオセンサーは、細胞内でタンパク質間相互作用を可視化するのに有用である。しかし、分子間型 FRET バイオセンサーを用いたタンパク質相互作用の検出には FRET 効率の変化を定量的に決定する必要がある。これには、ドナー蛍光のアクセプター蛍光タンパク質検出チャネルへの漏れこみや、アクセプター蛍光タンパク質の FRET によらない直接励起に伴う蛍光の補正が必要であり、ノイズが大きくなりがちである(図 1e)。このため、蛍光寿命を測定することで FRET 効率を測定するタイプの顕微鏡 (FLIM, Fluorescence lifetime microscope)がこの用途には使用されることが多い。詳細は FLIM の総説を参照されたい3) 。 D) 分子内型 FRET バイオセンサー分子内型 FRET バイオセンサーは、すべてのパーツを一つの分子に取り込んだものである(図 1 d)。ドナー蛍光分子とアクセプター蛍光分子の量が常に同じになることから、アクセプター蛍光タンパク質検出チャネルへの漏れこみや、アクセプター蛍光タンパク質の FRET によらない直接励起は一定になる。したがって、 FRET 効率の増減はドナーチャネルとアクセプターチャネルの蛍光量比をとるだけで十分評価することができる。欠点は、 FRET バイオセンサーの性能を決定する四つのパーツ(アクセプター蛍光タンパク質、ドナー蛍光タンパク質、リガンド領域、センサー領域)の配置をどうするのが良いかを試行錯誤して決めなければいけないという点にある。しかし、 GFP をベースにした FRET バイオセンサーが作られるようになってすでに 15 年経ち、多くの FRET バイオセンサーが手に入るようになった(ホームページを参照のこと)。現在、研究の多くはこの分子内型 FRET バイオセンサーを使ったものであるので、本稿ではこれに限定して話を進めたい。 E) 細胞の FRET 画像の代表例以下にいくつかの代表例を紹介する(図 2)。Raichu-Ras は、低分子量 GTP 結合タンパク質である Ras の活性を測定するものである。このバイオセンサーを使うことにより細胞増殖因子が Ras を細胞辺縁部の葉状突起で活性化することを初めて見出した(図 2a)4) 。また、セリンスレオニンリン酸化酵素 Raf のバイオセンサーを使い、Raf が細胞増殖刺激により細胞膜上で活性化される様子が可視化されている(図 2b)5) 。 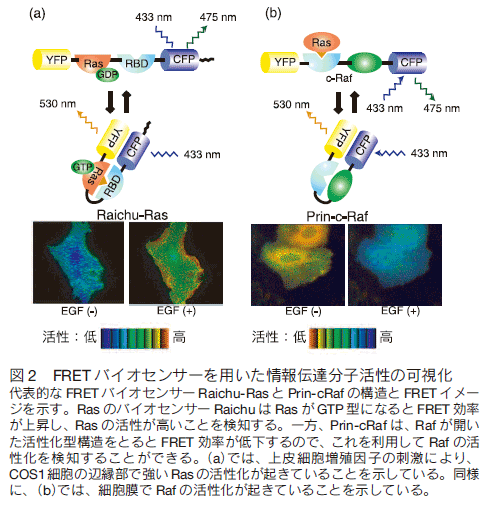 3. FRET バイオセンサーの高感度化A) 蛍光タンパク質の最適化既述の通り、分子内型 FRET バイオセンサーはその作製に労力を有する。筆者らは、高感度分子内型 FRET バイオセンサーを容易に作製するために、その骨格の最適化を行った6) 。 FRET 効率を決める主たる 3 因子のうち、まず、ドナーとアクセプター蛍光タンパク質の組み合わせの最適化を行った。これまでの FRET バイオセンサーの大部分は、シアン蛍光タンパク質(CFP)をドナー蛍光タンパク質に、黄色蛍光タンパク質(YFP)をアクセプター蛍光タンパク質としているので、CFP および YFP と蛍光特性の近い蛍光タンパク質をスクリーニングした7-10) 。その結果、ドナー蛍光タンパク質に ECFP もしくは nTurquoise-GL を、アクセプター蛍光タンパク質に YPet を用いた場合に最も高い FRET 効率が得られることが分かった。 B) リンカーの最適化ついで、残る二つの因子、すなわちアクセプター蛍光タンパク質とドナー蛍光タンパク質の間の距離と方向性の最適化である。これまで報告されている FRET バイオセンサーを見ると、リガンド領域とセンサー領域が結合した際に FRET 効率が上昇するものと下降するものに二分される。これらは、図 3 a,b に示すように、距離が主たる影響を与えているものと、方向性が主たる影響を与えているものがあるからだと解釈されている。論文中に記載されていることはほとんどないが、実際のところは、作ってみないとこのどちらのタイプになるかはわからない。より正直に言えば、試作されたバイオセンサーの大部分はどちらでもない。すなわち、リガンド領域とセンサー領域が結合しても FRET 効率が変化しないものが大部分であり、幸いにして FRET 効率が変化したものについて、後付けで a ないし b のモデルを書いているのが実態である。その最大の理由は、リガンド領域とセンサー領域が結合した状態の立体構造はほとんど手にいれることができず、方向性因子の寄与が全く予想できないからである。そこで筆者らは、方向性因子の寄与を無くするために、リガンド領域とセンサー領域が結合していない状況では FRET がほとんど起こらなくするシステム、すなわち Eevee (extension for enhanced visualization by evading extra FRET)システムを考えた。具体的にはリンカーを非常に長くしたのである(図 3c)。その結果、予想通り、リガンド領域とセンサー領域が結合していない状況での FRET 効率が低減し、リガンド領域とセンサー領域が結合した際の FRET 効率の上昇を大きくすることに成功した(図 3d)。筆者らはこのリンカーを EV リンカーと命名し、様々な FRET バイオセンサーに応用している。  4.安定発現培養細胞株の樹立A) FRET バイオセンサーの弱点論文にはほとんど書かれていない FRET バイオセンサーの大きな欠点がある。それは安定発現培養細胞株を作るのが非常に難しいということである。実際、論文となっている佐藤らの論文以外はほとんど報告がない11) 。レトロウイルスやレンチウイルスを使った場合は、おそらく逆転写反応の際に CFP 遺伝子と YFP 遺伝子との間の組換えが起きて、CFP もしくは YFP のみしか光らなくなるものが大部分である。また、直鎖状にした DNA をトランスフェクションでゲノムに導入する場合は、継代を重ねるにつれ、蛍光が減少していくのが普通である。 B) TFPを使った FRET バイオセンサー筆者らは、これらの問題がともに GFP 変異体である CFP と YFP の遺伝子配列がほとんど同じであることに起因していると考え、CFP をサンゴ由来の蛍光タンパク質 TFP 12) に替えた FRET バイオセンサーを作製した。その結果、予想通り、TFP をドナー蛍光タンパク質、YFP をアクセプター蛍光タンパク質にした FRET バイオセンサーはレトロウイルスを用いて容易に安定発現細胞株を樹立できることがわかった13) 。 C) レトロトランスポゾンを用いた遺伝子導入蛍光タンパク質の最適化の際に検討した結果、TFP をドナー蛍光タンパク質に用いた FRET バイオセンサーの感度は CFP をドナー蛍光タンパク質とした FRET バイオセンサーと比較して必ずしも高くはないことが明らかになった6) 。CFP と YFP との組み合わせのまま安定発現細胞株ができないか考えていたところ、理化学研究所の丹羽博士に piggyBac トランスポゾンを使う方法をご教示いただいた。実際、この方法を試してみると、きわめて容易に FRET バイオセンサーを安定発現する細胞株が樹立できることが分かった6) 。最近、Tol2 トランスポゾンを用いた系でも同様に安定発現細胞株が樹立できることを見出しており、トランスポゾンの種類は限定されないようである。 D) 安定発現培養細胞株の樹立一過性の発現では、細胞ごとによる FRET バイオセンサーの発現量の差が大きい。 FRET バイオセンサーの発現量はしばしばその FRET 効率に影響を与えるので、薬剤の効果等を測定するためには、一過性発現系は不向きである。従って FRET バイオセンサーを安定発現する細胞株の樹立法の確立は、薬剤スクリーニング系への道を拓くと考えられた。図 4a には、がん遺伝子情報伝達系の中の重要な分子である ERK の FRET バイオセンサーを発現する培養細胞株を一例として示している。さまざまな阻害剤が ERK 活性を抑制することが定量的に容易に調べられる。このような細胞を用いた薬剤効果の測定は、目的とする分子に直接作用する薬剤のみならず、広く情報伝達上流の制御分子やフィードバックを制御する分子の活性制御を司る分子に対する効果も容易に調べることができ、薬剤開発において重要な情報を与えてくれる。  5.生体組織での FRET イメージングA) 三次元培養での活性分布の可視化安定発現細胞株樹立の成功は、3 次元培養系や生組織内での FRET イメージングを可能とした。ここでは一例として、MDCK 細胞が腺管構造を作る過程における Rho ファミリー GTP 結合タンパク質の活性の空間分布について示す(図 4b)14) 。Rho ファミリー GTP 結合タンパク質はアクチン骨格系を制御する GTP 結合タンパク質で、RhoA は緊張線維を、Rac1 は葉状突起を、Cdc42 は糸状突起を誘導することが知られていた。これに呼応して、付着細胞では RhoA は、細胞の尾部と先端部で、Rac1 と Cdc42 は葉状突起や糸状突起で活性が高いことが知られていた。しかし、3 次元構造における Rho ファミリー GTP 結合タンパク質の活性制御は不明であった。筆者らは、Rho ファミリーGTP 結合タンパク質の FRET バイオセンサーを安定発現するイヌ尿管上皮由来 MDCK 細胞を樹立し、これらの細胞が 3 次元ゲル内で腺管を形成したときの GTP 結合タンパク質の活性分を調べた。腺管を形成した MDCK 細胞では、腺管内腔面では Cdc42 の活性が高く、側底面では Rac1 の活性が高いことが分かった。二次元培養においては、Rac1 と Cdc42 の活性は同じ部位で高いことが多いが、三次元においては厳密にその活性が空間的に制御されていることが明らかとなった。 B) 組織内での活性分布の可視化FRET バイオセンサーを安定発現する脳腫瘍細胞をラット脳に接種すると、脳腫瘍組織における Rho ファミリーGTP 結合タンパク質の組織内での活性分布をも可視化することができる15) 。脳腫瘍は通常、血管周囲に浸潤しやがて脳実質内に浸潤していく。図 4c に示すように、脳腫瘍細胞が脳内実質に浸潤する先端部では Rac1活性が高く、中心に近い部位では Rac1 活性が低いことが明らかとなった。この Rac1 活性が高い細胞を単離することで、もともとは均一であった脳腫瘍細胞のなかで実質組織に浸潤しやすい性質を有する細胞がどのような遺伝子発現パターンをとっているのかも調べることができる。 6.今後の発展現在の医学・生物学研究のトレンドは幹細胞研究に代表されるように、細胞集団の中の多様性の研究である。これは、細胞を集団として扱う生化学的研究手法がなかなか通じない研究領域であり、まさしく FRET バイオセンサーの出番といえる研究領域である。最近、 FRET バイオセンサーを発現するトランスジェニックマウスも作出されるに至り16)、細胞を抽出して解析するこれまでの研究手法から、 FRET バイオセンサーに代表されるイメージングツールを使った研究手法が発展していくことが予感される。
|
|||||||||||||||||||||||||||
| Copyright(c) 1996-2012 DOJINDO LABORATORIES, ALL Rights Reserved. |

