 |
| 丂僩僢僾儁乕僕 > 偑傫嵶朎傪惂屼偡傞僄僺僕僃僱僥傿僋僗 |
 |
||||||||||
偑傫嵶朎傪惂屼偡傞僄僺僕僃僱僥傿僋僗
|
||||||||||
 |
嬤摗朙丂乮Yutaka Kondo) 垽抦導偑傫僙儞僞乕尋媶強 暘巕庮釃妛晹 |
亂梫栺亃
丂Besides known genetic changes, aberrant epigenetic alterations have emerged as common hallmarks of many human cancers. Epigenetic silencing in cancer cells is regulated by multiple factors,丂DNA methylation, histone modifications, chromatin structure, and non-coding RNA. 丂It has been recognized that dysregulation of epigenetic mechanisms is found in almost all types of cancers and contributes to malignant transformation via silencing multiple tumor suppressor genes.丂Therefore, deciphering the epigenetic signature in each tumor type is required to better understand tumor behavior and might be of benefit for clinical diagnostics and therapy.丂In this essay, the current key topics including our findings in cancer epigenetics are introduced and briefly discussed.
僉乕儚乕僪丗
僄僺僕僃僱僥傿僋僗丄偑傫丄DNA 儊僠儖壔丄僸僗僩儞廋忺丄偑傫姴嵶朎
1丏偼偠傔偵
丂暘巕惗暔妛偺恑曕偵敽偄丄惗懱撪偱偺暘巕憡屳嶌梡偵婎偯偔惗柦尰徾傗丄偦偺挷愡堎忢偵婲場偡傞條乆側幘姵敪徢偺儊僇僯僘儉偑柧傜偐偵側傝偮偮偁傞丅嵶朎偺摥偒傪挷愡偡傞僞儞僷僋幙偺敪尰偵偼丄堚揱巕偺揮幨丒東栿偑娭傢偭偰偍傝乮僕僃僱僥傿僋僗乯丄堚揱巕偺揮幨丒東栿偺挷愡偵偼僄僺僕僃僱僥傿僋僗偑婑梌偟偰偄傞丅偝傜偵僄僺僕僃僱僥傿僋僗偼丄僞儞僷僋幙偵傛傝惂屼偝傟偰偄傞偙偲偐傜丄惗柦婡擻偵娭傢傞僕僃僱僥傿僋僗亅僄僺僕僃僱僥傿僋僗亅僞儞僷僋幙偺摑崌揑挷愡婡峔偼丄惗柦尰徾偺拞怱揑栶妱傪扴偭偰偄傞偲峫偊傞丅
丂僄僺僕僃僱僥傿僋僗偼丄嵶朎偺敪惗丒暘壔丒榁壔丄儕僾儘僌儔儈儞僌側偳懡嵤側惗暔妛揑尰徾偵娭傢偭偰偄傞丅嵶朎偺儕僾儘僌儔儈儞僌偵娭傢傞偙偲偐傜嵞惗堛椕丒惗怋堛椕暘栰偵寚偐偣側偄奣擮偱偁傝丄傑偨僄僺僕僃僱僥傿僋僗偺堎忢偼丄摑崌幐挷徢傗惗妶廗姷昦丄偦偟偰丄偲傝傢偗偑傫偺敪徢偵怺偔娭梌偡傞偲峫偊傜傟偰偄傞丅
丂尰嵼丄擔杮恖偺 3 恖偵 1 恖偼偑傫偱巰朣偡傞偲偝傟偰偍傝丄摥偒惙傝偺擭戙偵偍偗傞偑傫巰偼幮夛揑栤戣偵傕側偭偰偄傞丅堦斒偵屌宍庮釃偼慻怐懡條惈傪帵偡偙偲偑懡偔丄庮釃撪偵崅偄揮堏擻丒怹弫擻傪帩偭偨嵶朎廤抍偑懚嵼偡傞応崌偑偟偽偟偽尒傜傟傞丅堛椕偺恑曕偵傛傝偑傫偵懳偡傞帯椕惉愌偑岦忋偟偮偮偁傞偑丄怹弫丒嵞敪丒揮堏傪偒偨偡偑傫偼丄埶慠偲偟偰桳岠側帯椕朄偑尷傜傟崕暈偡傋偒壽戣偱偁傞丅
丂嵟嬤偺尋媶偐傜丄偑傫嵶朎偵偼僕僃僱僥傿僢僋側堚揱巕堎忢偵壛偊偰丄條乆側僄僺僕僃僱僥傿僢僋堎忢偑拁愊偟偰偄傞偙偲偑柧傜偐偵側偭偰偒偨丅僄僺僕僃僱僥傿僢僋堎忢偼偑傫偺敪惗憗婜偺抜奒偐傜敪堢恑揥偵偄偨傞傑偱丄偦偺摿惈偵戝偒偔塭嬁傪梌偊偰偄傞丅僄僺僕僃僱僥傿僢僋側堎忢偺塭嬁偼丄峀斖偵堚揱巕惂屼堎忢偵媦傇偲峫偊傜傟偰偍傝丄偑傫偵偍偗傞僄僺僕僃僱僥傿僢僋堎忢偺夝柧偼丄偑傫堛椕傪峫偊偰偄偔忋偱媔嬞偺壽戣偱偁傞丅僄僺僕僃僱僥傿僢僋婡峔偵偼丄埨掕偟偨廋忺偱偁傞 DNA 儊僠儖壔丄壜媡惈傪曐帩偟偰偄傞僸僗僩儞廋忺丄偝傜偵偼僋儘儅僠儞峔憿曄壔傗丄旕東栿 RNA 側偳偺暋悢偺僄僺僕僃僱僥傿僋僗婡峔偑懡嵤側僋儘僗僩乕僋傪夘偟偰堚揱巕敪尰傪挷惍偟偰偄傞乮恾1乯丅
丂嵟嬤 DNA 儊僠儖壔傗僸僗僩儞廋忺堎忢傪昗揑偲偟偨帯椕偑椪彴偺応偵庢傝擖傟巒傔偰偍傝丄偑傫嵶朎偵偍偗傞僄僺僕僃僱僥傿僋僗惂屼婡峔傪棟夝偡傞偙偲偼丄偑傫偺敪惗丒恑揥偵娭傢傞惂屼婡峔偺夝柧偵偮側偑傝丄桳岠側恌抐丒帯椕昗揑偲偟偰偺揥朷偑婜懸偱偒傞丅
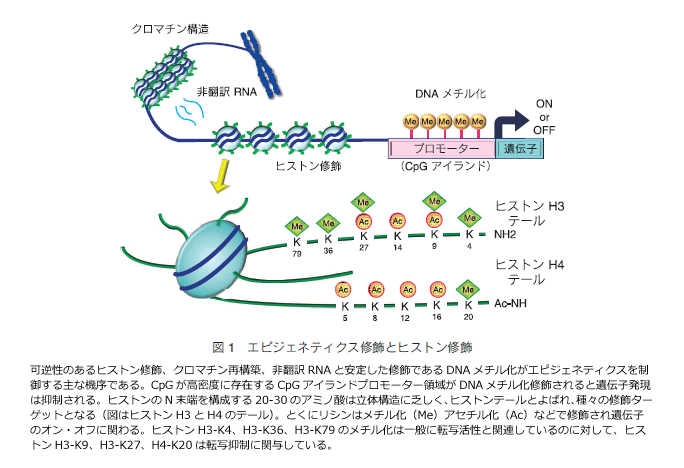
2丏DNA 儊僠儖壔堎忢
丂僸僩偺堚揱巕傪徻偟偔娤嶡偡傞偲丄尷嬊揑偵 CpG 偵晉傓 500亅2000 bp 偺椞堟偑偁傝丄偙偺椞堟偺 CpG 偺僔僩僔儞偼儊僠儖壔廋忺偝傟偰偄側偄乮CpG 傾僀儔儞僪乯丅僸僩偺僴僂僗僉乕僺儞僌堚揱巕乮嵶朎偑惗懚偡傞偨傔偵昁恵側偨傫傁偔幙傪僐乕僪偡傞堚揱巕孮乯偺栺 60亾 偼 CpG 傾僀儔儞僪傪僾儘儌乕僞乕椞堟偵桳偡傞偲峫偊傜傟偰偄傞丅1990 擭戙偵擖傝丄偑傫梷惂堚揱巕偱偁傞 Rb 堚揱巕偺 CpG 傾僀儔儞僪偺 DNA 儊僠儖壔偲堚揱巕敪尰梷惂偲偺娭楢偑敪尒偝傟偨 1乯丅偦偺屻憡師偄偱 DNA 儊僠儖壔偲堚揱巕敪尰梷惂偲偺憡娭偑丄偑傫梷惂堚揱巕偱偁傞 p16 堚揱巕傗 VHL 堚揱巕側偳偱曬崘偝傟丄尰嵼偱偼丄DNA 儊僠儖壔偼堚揱巕晄妶壔婡峔偺拞偱寚幐丒曄堎偵師偖戞 3 偺儊僇僯僘儉偲偟偰擣幆偝傟偮偮偁傞 2乯丅丂庮釃偲 DNA 儊僠儖壔堎忢偺娭楢偼丄屆偔偼儊僠儖壔僔僩僔儞偺娷桳検偺専摙傛傝丄庮釃偱偼堦斒偵 DNA 偼掅儊僠儖壔忬懺偵偁傞偙偲偑傢偐偭偰偄偨丅庮釃偺掅儊僠儖壔偼僎僲儉撪偺斀暅攝楍偺掅儊僠儖壔偵婲場偡傞偲峫偊傜傟偰偄傞丅偡側傢偪偑傫嵶朎偵偍偗傞 DNA 儊僠儖壔偼丄僎僲儉慡懱偺掅儊僠儖壔忬懺偲摿掕偺堚揱巕偺 CpG 傾僀儔儞僪偵偍偗傞崅儊僠儖壔偑摿挜偱偁傝丄惓忢嵶朎偲偼堎側偭偨忬懺偲側偭偰偄傞丅
丂偑傫嵶朎偱偼丄DNA 儊僠儖壔偵傛偭偰偟偽偟偽暋悢偺堚揱巕偑摨帪偵梷惂偝傟偰偄傞丅DNA 儊僠儖壔偺昿搙偼堚揱巕偛偲偵堎側傝丄壛楊偲偲傕偵 DNA 儊僠儖壔儗儀儖偑忋徃偡傞堚揱巕傗丄偑傫摿堎揑偵 DNA 儊僠儖壔偡傞堚揱巕偑偁傞偙偲偑傢偐偭偰偄傞丅偑傫嵶朎偺桼棃憻婍偵傛偭偰傕僞乕僎僢僩偲側傞堚揱巕偼堎側傞 3,4乯丅
偙偆偟偰傒傞偲 DNA 儊僠儖壔堎忢偼丄堦尒儔儞僟儉側帠徾偺傛偆偵巚偊傞偑丄幚嵺偼儔儞僟儉偱偼側偔慖戰惈偑偁傞偙偲偑傢偐偭偰偄傞丅傑偨嵟嬤偺栐梾揑夝愅偵傛傝丄敪偑傫夁掱偵娭楢偟側偄堚揱巕偺 CpG 傾僀儔儞僪偑崅昿搙偵儊僠儖壔偟偰偄傞偙偲偑尒弌偝傟偰偄傞偙偲偐傜丄昁偢偟傕憹怋偵桳棙側傛偆偵堚揱巕偑儊僠儖壔偡傞傢偗偱偼側偄偙偲傕傢偐偭偰偒偨 5乯丅
丂DNA 儊僠儖壔昗揑堚揱巕偺偆偪丄E-cadherin乮CDH1乯傗 Tissue inhibitor of metalloproteinase-3乮TIMP-3乯堚揱巕摍偺偑傫偺怹弫丒揮堏傪梷惂偡傞堚揱巕偑僒僀儗儞僔儞僌偝傟傞偲丄偑傫偼崅揮堏擻丒崅怹弫擻傪傕偮偑傫偵側傞丅傑偨 O6-methylguanine DNA methyltransferase乮MGMT乯堚揱巕偑儊僠儖壔偡傞偲丄堚揱巕廋暅偵堎忢偑婲偙傞 6乯丅偝傜偵戝挵偑傫丄擼庮釃乮僌儕僆乕儅乯丄擕偑傫偺堦晹偺徢椺偱 DNA 儊僠儖壔偑崅昿搙偵拁愊偟乮CIMP : CpG island methylator phenotype)丄摿堎側椪彴憸傪帵偡偙偲偑曬崘偝傟偰偍傝丄DNA 儊僠儖壔堎忢偼丄偑傫偺昦懺偵塭嬁偟偰偄傞偲峫偊傜傟傞 7-9乯丅偟偨偑偭偰丄偑傫嵶朎偵摿挜揑側 DNA 儊僠儖壔堎忢偺専弌丄偝傜偵偑傫偺惈幙偵塭嬁傪梌偊傞摿挜揑側僄僺僕僃僱僥傿僋僗僾儘僼傽僀儖傪柧傜偐偵偡傞偙偲偼丄偑傫偺屄惈偵墳偠偨帯椕曽恓寛掕偵傕偮側偑傞偲峫偊傞丅
3丏DNA 儊僠儖壔堎忢偺恌抐傊偺墳梡
丂偑傫偺恌抐儅乕僇乕偲偟偰偺 DNA 儊僠儖壔堎忢偺専弌偼偄偔偮偐偺棙揰偑偁傞丅椺偊偽丄嘆 DNA 儊僠儖壔偼埨掕偟偨廋忺偱偁傝丄DNA 帺恎傕 RNA 傗僞儞僷僋偵斾傋傞偲旕忢偵埨掕偟偰偄傞偨傔専懱偲偟偰梡偄傗偡偄丄嘇 MethyLight 傗僷僀儘僔乕僋僄儞僗朄側偳偺惛搙偺崅偄斾妑揑娙曋側傾僢僙僀朄偑偁傞丄嘊 偑傫偵摿堎揑偵 DNA 儊僠儖壔偡傞堚揱巕偑懚嵼偡傞丄側偳偑嫇偘傜傟傞 10乯丅忋弎偺傛偆偵堦晹偺偑傫偱偼丄DNA 儊僠儖壔堎忢偑丄偑傫偺昦懺偲娭楢偟偰偄傞偨傔丄DNA 儊僠儖壔堎忢偺専弌傪丄偑傫偺恌抐丒帯椕偵墳梡偡傞帋傒偑峴傢傟偰偄傞丅
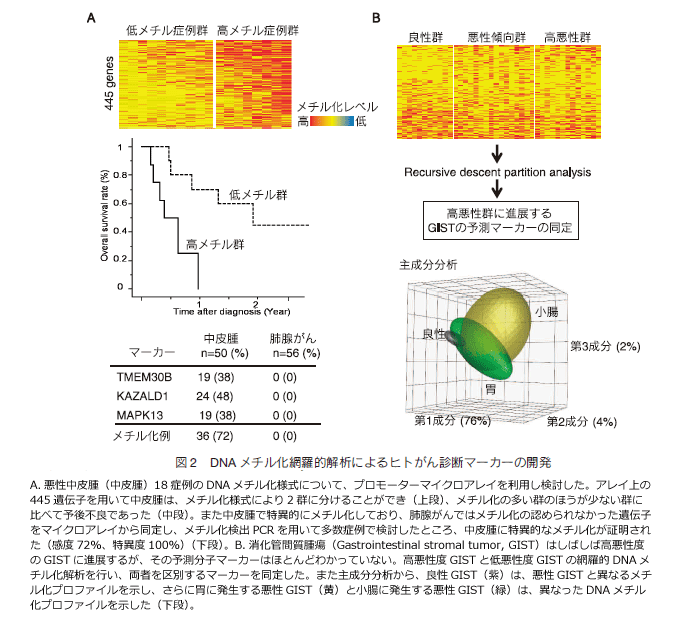
丂MGMT 堚揱巕偺儊僠儖壔偼丄僌儕僆僽儔僗僩乕儅偵懳偡傞傾儖僇儕壔嵻乮Temozolomide乯帯椕傊偺姶庴惈傪昡壙偡傞偨傔偵桳梡偱偁傞 11乯丅媔墝幰偺歕醾拞偺 p16丄MGMT 偺儊僠儖壔専弌偼丄旕彫嵶朎惈攛偑傫偲椪彴揑偵恌抐偝傟傞栺 3 擭慜偐傜婛偵専弌偱偒傞偲曬崘偝傟偰偍傝丄憗婜恌抐儅乕僇乕偲偟偰偺 DNA 儊僠儖壔偺桳梡惈偑帵偝傟偨 12乯丅嵟嬤丄巹偨偪偺尋媶幒偱偼栐梾揑夝愅偐傜丄偑傫偺拞偱傕丄摿偵偙傟傑偱偁傑傝夝愅偑偝傟偰偄側偐偭偨庮釃偵徟揰傪峣傝丄懚嵼丒昦懺恌抐偵墳梡偱偒傞儅乕僇乕偺摨掕傪帋傒偰偄傞丅埆惈嫻枌拞旂庮偼傾僗儀僗僩偺朶業屻偵敪徢偡傞梊屻偑嬌傔偰埆偄幘姵偱偁傞丅埆惈嫻枌拞旂庮偲攛態偑傫偺栐梾揑側儊僠儖壔夝愅傪峴偄丄拞旂庮摿堎揑偵儊僠儖壔偟偰偄傞堚揱巕傪尒弌偟偨乮恾2乯丅偙傟傜偺儅乕僇乕傪梡偄偨嫻悈側偳偺椪彴専懱傊偺墳梡偑婜懸偱偒傞 13乯丅徚壔娗娫幙庮釃乮Gastrointestinal stromal tumor, GIST乯偼丄KIT 堚揱巕傗 PDGFRα 堚揱巕偺曄堎傪憗婜偐傜崅昿搙偵擣傔傞丅偟偽偟偽崅埆惈搙偺 GIST 偵恑揥偡傞偑丄偦偺梊應暘巕儅乕僇乕偼傎偲傫偳傢偐偭偰偄側偄丅崅埆惈搙 GIST 偲掅埆惈搙 GIST 偺栐梾揑 DNA 儊僠儖壔夝愅傪峴偄丄椉幰傪嬫暿偡傞儅乕僇乕傪摨掕偟偨丅傑偨偦偺夁掱偱堓偵敪惗偡傞 GIST 偲彫挵偵敪惗偡傞 GIST 偼丄堎側偭偨 DNA 儊僠儖壔僾儘僼傽僀儖傪掓偟偦傟偧傟撈棫偟偨幘姵偱偁傞偲峫偊偨 14乯乮恾2乯丅
丂戝挵偑傫偱偼丄CIMP乮忋弎乯偺懚嵼偑 1990 擭戙屻敿傛傝採彞偝傟偰偒偨偑丄嵟嬤 DNA 儊僠儖壔偺栐梾揑夝愅偵傛傝丄擼庮釃乮僌儕僆僽儔僗僩乕儅乯丄擕偑傫偱偦偺懚嵼偑徹柧偝傟丄摿挜揑側椪彴憸傪掓偡傞偙偲偑傢偐偭偰偒偨 7,9,8乯(昞1乯丅偙傟傑偱偺尋媶偐傜丄偝傜偵暿偺偑傫庬偱傕 CIMP 偑懚嵼偡傞壜擻惈偑崅偄偲峫偊傜傟傞丅偦偺徹柧偵偼丄傑偢 DNA 儊僠儖壔偺栐梾揑夝愅偵傛傝儊僠儖壔偑崅搙拁愊偟偨 CIMP 徢椺傪摨掕偟丄偦傟傜偺 CIMP 徢椺傪岠棪揑偵慖暿壜擻側儊僠儖壔儅乕僇乕傪梡偄偰丄CIMP 徢椺偺摿挜揑側椪彴昦棟妛揑攚宨傪柧傜偐偵偡傞偙偲偑昁梫偱偁傞丅偝傜偵椪彴憸傪柧傜偐偵偡傞偙偲偱丄偦傟傜偺偑傫偺屄惈偵崌傢偣偨帯椕朄傪彨棃慖戰偡傞偙偲偑婜懸偝傟傞丅

4丏偑傫偺壜慪惈偵娭傢傞僄僺僕僃僱僥傿僋僗
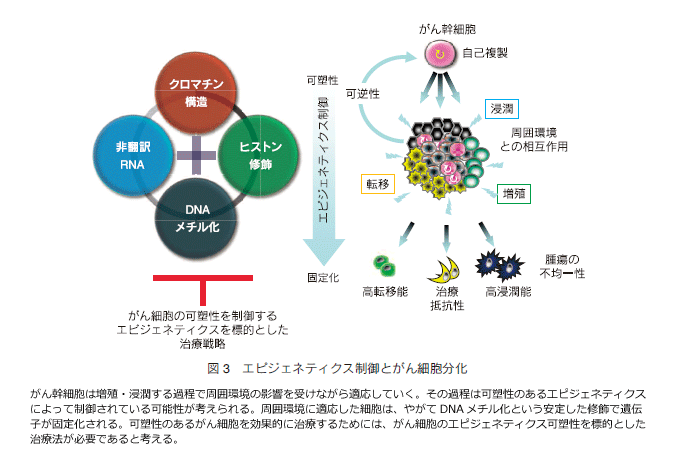
丂堦曽丄偑傫宍惉偵婑梌偡傞僄僺僕僃僱僥傿僢僋堎忢偼丄DNA 儊僠儖壔偺傒側傜偢丄僸僗僩儞廋忺偵傛傞堚揱巕偺晄妶壔傕廳梫側栶妱傪壥偨偟偰偄傞乮恾1乯丅梷惂宯偺僸僗僩儞廋忺偲偟偰僸僗僩儞 H3 儕僔儞乮K乯9 偺儊僠儖壔偼 DNA 儊僠儖壔偲嫟懚偡傞偙偲偑懡偔丄嫮屌側堚揱巕晄妶壔婡峔偲偟偰摥偔 15乯丅暿偺梷惂惈僸僗僩儞廋忺偱偁傞 H3K27 僩儕儊僠儖壔乮H3K27me3乯偼 DNA 儊僠儖壔偵旕埶懚揑偵堚揱巕傪晄妶壔壜擻偱偁傝 16乯丄偝傜偵堦晹偺堚揱巕偱偼 DNA 儊僠儖壔偵愭峴偡傞廋忺偱傕偁傞偙偲偑傢偐偭偰偒偨丅偑傫嵶朎偱偼偙偆偟偨暋悢偺僄僺僕僃僱僥傿僋僗婡峔偑僱僢僩儚乕僋傪宍惉偟丄偑傫偺敪惗丒恑揥偵娭傢偭偰偄傞偲悇應偝傟傞乮恾3乯丅
丂嵟嬤丄泱惈姴嵶朎乮ES 嵶朎乯傪梡偄偨尋媶偐傜丄偦偺暘壔惂屼偵偼億儕僐乕儉僞儞僷僋傪夘偟偨 H3K27me3 廋忺偑怺偔娭梌偟偰偄傞偙偲偑暘偐偭偰偒偨丅偑傫偑尦棃儌僲僋儘乕僫儖側憹怋嵶朎傪婲尮偲偡傞偲峫偊傞偲丄偑傫嵶朎偵偍偄偰傕慻怐懡條惈傪妉摼偟偰偄偔夁掱偱丄億儕僐乕儉僞儞僷僋傪偼偠傔偲偡傞僄僺僕僃僱僥傿僋僗婡峔偑丄偦偺暘壔傪惂屼偟偰偄傞壜擻惈偑梊應偝傟傞丅偑傫慻怐撪偵偼帺屓暋惢擻偲懡暘壔擻傪帩偮姴嵶朎條偑傫嵶朎乮偑傫姴嵶朎乯偑懚嵼偡傞偲峫偊傜傟偰偄傞 17,18乯丅巹偨偪偺尋媶幒偱偼丄屌宍庮釃偑慻怐懡條惈傪帵偡攚宨偵丄偑傫姴嵶朎偺懚嵼偲丄壜慪惈偺偁傞僄僺僕僃僱僥傿僢僋側惂屼婡峔偑娭梌偟偰偄傞偲峫偊丄擼庮釃姴嵶朎乮Gliomastem cell, GSC乯傪庽棫偟偰丄偦偺庮釃嵶朎暘壔偵娭傢傞僄僺僕僃僱僥傿僋僗婡峔偺夝柧傪帋傒偰偄傞丅GSC 偺暘壔桿摫偵偼億儕僐乕儉僞儞僷僋偺傂偲偮偱偁傞 EZH2 乮H3K27 儊僠儖壔峺慺乯傪偼偠傔偲偡傞僄僺僕僃僱僥傿僋僗婡峔偑丄偦偺暘壔傪惂屼偟偰偄傞壜擻惈偑梊應偝傟傞僨乕僞傪摼偰偄傞丅條乆側庮釃偱偑傫姴嵶朎偺懚嵼偑峫偊傜傟偰偄傞偑丄偙偺偑傫姴嵶朎偺堐帩偵傕 ES 嵶朎偲摨條偵億儕僐乕儉僞儞僷僋偵傛傞壜慪惈偺偁傞堚揱巕惂屼偑廳梫側摥偒傪偟偰偄傞偲悇應偝傟傞丅偑傫嵶朎偼憹怋丄怹弫丄揮堏偟偰偄偔側偐偱廃埻偺娐嫬偐傜偺塭嬁傪庴偗側偑傜偦偺娐嫬偵揔墳偟偰偄偔偑丄偦偺嵺偵傕 H3K27me3 廋忺傪拞怱偲偟偨僄僺僕僃僱僥傿僋僗惂屼婡峔偑娭梌偟偰偄傞偲峫偊傞丅偙偺婡峔偵傛傝丄偑傫嵶朎偼壜慪惈傪曐偪丄崅偄揮堏擻丄怹弫擻丄帯椕掞峈惈偲偄偭偨偑傫慻怐偺晄嬒堦惈傗懡條惈偺宍惉偵偮側偑傞偲峫偊傞丅偝傜偵 H3K27me3 廋忺偲偄偆壜慪惈偺偁傞曄壔偼丄傗偑偰 DNA 儊僠儖壔偲偄偆埨掕偟偨曄壔偵抲偒姺傢傞偺偐傕偟傟側偄乮恾3乯 19乯丅
5丏僄僺僕僃僱僥傿僋僗帯椕偵岦偗偰
丂忋弎偺傛偆偵偑傫嵶朎偺僄僺僕僃僱僥傿僢僋堎忢偼懡嵤偵偑傫偺惗暔妛揑摿惈偵娭傢偭偰偄傞丅僄僺僕僃僱僥傿僋僗帯椕偺栚昗偼丄僄僺僕僃僱僥傿僢僋堎忢偵傛傝扙惂屼偝傟偰偄傞堚揱巕婡擻傪惓忢忬懺偵栠偡偙偲偵偁傞丅DNA 儊僠儖壔偵傛傝敪尰梷惂偝傟偨偑傫梷惂堚揱巕偼丄DNA 扙儊僠儖壔嵻帯椕偵傛傝嵞妶惈壔傪栚巜偡偙偲偑壜擻偱偁傞丅椪彴偱梡偄傜傟偰偄傞扙儊僠儖壔嵻偵偼 5-azacytidine丄5-aza-2’-deoxycytidine 偑偁傝丄椉幰偲傕僰僋儗僆僠僪偺傾僫儘僌偲偟偰 DNA 崌惉偺嵺偵庢傝崬傑傟丄DNA 儊僠儖壔峺慺傪僩儔僢僾偡傞偙偲偱偦偺妶惈傪梷偊傞 20乯丅擔杮偱傕崪悜堎宍惉徢岓孮偺帯椕偵庢傝擖傟傜傟偰偍傝丄憈岠棪偼 20-30亾 偲曬崘偝傟偰偄傞丅摿偵 DNA 扙儊僠儖壔嵻偵傛傞帯椕斀墳惈偑椙偄徢椺孮偱偼丄帯椕屻偺扙儊僠儖壔儗儀儖偺曄壔偑傛傝尠挊偱偁傞 21乯丅尰嵼 DNA 扙儊僠儖壔嵻偼丄崪悜堎宍惉徢岓孮偺傒偱偼側偔媫惈崪悜惈敀寣昦側偳偺寣塼庮釃偵懳偟偰傕帯尡偑恑傔傜傟偰偄傞 22乯丅
丂僸僗僩儞扙傾僙僠儖壔峺慺乮HDAC乯慾奞嵻偺偆偪椪彴墳梡偵偝傟偰偄傞栻嵻偼丄僶儖僾儘儞巁丄suberoylanilide hydroxamic acid 乮SAHA乯側偳偱丄寣塼庮釃傪拞怱偵偙傟傜偺栻嵻傪梡偄偨帯椕偑峴傢傟偰偄傞丅HDAC 慾奞嵻偼 p21 偺敪尰傪桿摫偡傞偙偲傗丄p53 傪妶惈壔偡傞偙偲偱丄嵶朎廃婜傪掆巭偝偣偨傝丄傾億僩乕僔僗傪桿摫偡傞偙偲偵傛傝峈庮釃岠壥傪帵偡偲峫偊傜傟偰偄傞丅傑偨晄妶壔偝傟偨堚揱巕偺傾僙僠儖壔傪桿摫偡傞偙偲偱暋悢偺堚丂揱巕偺嵞妶惈壔偵傕偮側偑傞丅
丂HDAC 慾奞嵻偲偦偺懠偺暘巕昗揑帯椕栻偲偺暪梡傕帋傒傜傟偰偄傞丅媫惈慜崪悜媴惈敀寣昦乮APL乯偼丄價僞儈儞 A 惢嵻偱偁傞僆乕儖僩儔儞僗儗僠僲僀儞巁乮ATRA乯偵傛傞暘壔桿摫椕朄偑桳岠側応崌偑懡偄偑丄帪偵 ATRA 帯椕掞峈惈偺 APL 傕懚嵼偡傞丅偦偺傛偆側 APL 偵懳偟偰 HDAC 慾奞嵻偲 ATRA 偺暪梡偵傛偭偰暘壔偑桿摫偝傟偨曬崘偑偁傞 23乯丅堦斒偵 EGFR 乮忋旂惉挿場巕庴梕懱乯偵曄堎偑偁傞旕彫嵶朎惈攛偑傫偼僠儘僔儞僉僫乕僛慾奞嵻乮TKI乯偵姶庴惈偑崅偄丅TKI 偵懴惈傪帵偡傛偆偵側偭偨 EGFR 曄堎宆攛偑傫嵶朎姅偵懳偟偰丄HDAC 慾奞嵻偲 TKI 偺暪梡搳梌傪峴偭偨寢壥丄TKI 姶庴惈偑夞暅偟憹怋梷惂岠壥偑尒傜傟傞傛偆偵側偭偨 24乯丅
丂僸僗僩儞儊僠儖壔峺慺慾奞嵻偺椪彴墳梡傕恑傒偮偮偁傞丅3-deazaneplanocin A 乮DZNep乯偼傕偲傕偲峈僂僀儖僗嵻偲偟偰奐敪偝傟偨偑丄EZH2 傪娷傓 PRC2 傪慾奞偡傞偙偲偱 H3K27 僩儕儊僠儖壔傪梷偊丄偑傫嵶朎傪傾億僩乕僔僗偵摫偔偙偲偑偱偒傞偲曬崘偝傟偨 25乯丅Suva 傜偼擼庮釃偺偑傫姴嵶朎偵偍偄偰 DZNep 偼宍懺偺曄壔傪偍偙偟丄憹怋梷惂傪傕偨傜偡偙偲傪曬崘偟偰偄傞 26乯丅暷崙偱偼 Epizyme 幮偲 GlaxoSmithKline 幮偑 EZH2 慾奞嵻傪摨掕偟丄椪彴墳梡傊偺揥奐傪媫懍偵恑傔偰偄傞丅
丂嬤擭偺偑傫帯椕偱偼敪偑傫偵娭傢傞屌桳偺暘巕傪昗揑偲偡傞暘巕昗揑栻偑奐敪偝傟丄偡偖傟偨岠壥傪帵偟偰偄傞丅僄僺僕僃僱僥傿僋僗傪昗揑偲偟偨帯椕栻傕椪彴墳梡偝傟丄堦晹偺庮釃偵懳偟偰桳岠偱偁傞偙偲偑傢偐傝丄偑傫帯椕愴棯偺怴偟偄慖戰巿偲側傝偮偮偁傞丅堦曽偱偑傫偺僄僺僕僃僱僥傿僋僗帯椕偵偼偄偔偮偐偺栤戣偑巆偝傟偰偄傞丅椺偊偽扙儊僠儖壔嵻傗僸僗僩儞傾僙僠儖壔峺慺慾奞嵻偲偄偭偨僄僺僕僃僱僥傿僋僗帯椕栻偼丄廋忺峺慺偺慾奞偑捈愙偺嶌梡偱偁傝丄懠偺暘巕昗揑栻偲摨條偵嶌梡婡彉偑柧妋偱偁傞偑丄偦偺壓棳偺昗揑偵偼晄柧側揰偑懡偄丅傑偨懡嵤側僄僺僕僃僱僥傿僋僗婡峔偵懳偟偰帯椕栻偺庬椶偑尷傜傟偰偍傝丄怴偨側帯椕栻偺奐敪偑愗朷偝傟偰偄傞丅崱屻丄恀偺暘巕昗揑栻偲偟偰偺僄僺僕僃僱僥傿僋僗帯椕傪揥奐偟偰偄偔忋偱丄摿堎惈傪偳偺傛偆偵偁偘偰偄偔偐丄傑偨偳偺徢椺偵懳偟偰僄僺僕僃僱僥傿僋僗帯椕傪峴偭偰偄偔偐偼廳梫側壽戣偱偁傞丅傛傝桳岠側帯椕朄傪慖戰偡傞忋偱丄屄乆偺偑傫偺僄僺僕僃僱僥傿僢僋堎忢偵偮偄偰偺尋媶偺揥奐偑婜懸偝傟傞丅
| 昅幰徯夘 | |
| 柤慜 | 嬤摗 朙丂乮Yutaka丂Kondo乯丂45 嵨 |
|---|---|
| 強懏 | 垽抦導偑傫僙儞僞乕尋媶強丂暘巕庮釃妛晹 |
| 楢棈愭 | 仹464-8681丂 垽抦導柤屆壆巗愮庬嬫幁巕揳1-1 TEL丗 052-762-6111乮7073乯 丂FAX丗 052-764-2993 |
| 棯楌 | 丂1990擭柤屆壆巗棫戝妛堛妛晹懖乮MD乯丄懖屻 6 擭傎偳椪彴堛傪偟偰偄傑偟偨偑丄巚偄棫偭偰戝妛堾偵恑妛偟 2000 擭 PhD 庢摼丅 丂尰嵼偺尋媶僥乕儅偼丄偑傫僄僺僕僃僱僥傿僋僗丄僄僺僕僃僱僥傿僋僗傪昗揑偲偟偨恌抐丒帯椕朄偺奐敪丅庯枴偼撉彂丄壒妝娪徿丅怉暔傪堢偰傞偙偲丅擏傪從偄偰怘傋傞偙偲丅怉偊偨憪栘偑丄偁傞帪婜偵夎悂偒奐壴偡傞偺傪栚偵偡傞偲帺慠偺椡嫮偝偵姶摦偟傑偡丅 |
| Copyright(c) 1996-2011 DOJINDO LABORATORIES,丂ALL Rights Reserved. |