細胞周期の進行を時間・空間的にリアルタイムで可視化する技術
株式会社同仁化学研究所 日吉 友香
細胞は増殖する際、DNA複製によりDNAを2倍にし、細胞分裂の過程で均等に染色体を分配して2つの娘細胞を形成する。この現象は周期的に起こることから細胞周期と呼ばれる。
細胞周期についてはこれまで様々な手法によって活発に研究されており、詳細な分子メカニズムが次々と明らかにされてきた。
細胞周期はG1期(DNA合成準備期)、S期(DNA合成期)、G2期(分裂準備期)、M期(分裂期)、G0期(静止期)に分かれている。2001年にノーベル医学・生理学賞を受賞したHartwellらによって細胞周期の主な制御因子群が発見され、細胞周期の分子メカニズム解析は躍進的に進歩し多くの成果をあげている。細胞周期で最も重要な制御因子はcyclinとcyclin dependent kinase(CDK)の複合体であり、cyclin と CDK には、それぞれ約10種類のサブタイプが存在している。G0/G1期移行はcyclin D-CDK4複合体、G1/S期移行はcyclin E-CDK2複合体、S期進行はcyclin A-CDK2複合体、G2期進行はcyclin A-CDK1複合体、G2/M期移行はcyclin B-CDK1複合体が制御していることなどが解明されている。
これまでの研究では、1つの細胞に着目して細胞周期のメカニズムが解析されてきた。一方、多くの細胞から成る個体では、細胞は存在する場所によって異なる調節を受けて細胞周期が進行し、組織や器官を形成・維持していると考えられている。しかし、多細胞生物の胚発生における形態形成、ガン細胞の増殖や浸潤、転移などと細胞周期がどのように関わっているのかはよくわかっていない。組織や器官、個体において、各々の細胞が「いつ、どこで、どのように」細胞周期が制御されているかを理解することは、基礎生物学分野の理解を深めるだけでなく、再生医療やガン研究などの医療分野においても重要である。
従来、生きた細胞や組織における細胞周期進行は、光学顕微鏡を用いた観察により解析されてきた。細胞周期のM期からG1期への移行は、染色体や紡錘体の出現、細胞分裂などの形態的変化が起こるため光学顕微鏡で識別することができる。しかし、細胞周期の開始ポイントであるG1期からS期への移行は、形態変化を伴わないため、光学顕微鏡で識別することができない。そこで、G1/S期移行を解析するために、nuclear romodeoxyuridine(BrdU)を使った細胞染色が用いられてきた。この方法は、DNA合成の際にBrdUを取り込ませた後、細胞を固定して抗BrdU抗体で染色する必要があり、生きた状態をリアルタイムで観察することができない。そのため、生きた組織において細胞周期進行を時間空間的にリアルタイムで可視化する技術の開発が求められてきた。
2008年ノーベル化学賞を受賞した下村脩によってオワンクラゲから単離された緑色蛍光タンパク質(green fluorescent protein: GFP)は、目的タンパク質と融合させて細胞に発現させることで、タンパク質の細胞内局在や特定細胞の体内分布を観察するためのレポータータンパク質として利用されている。このGFPタンパク質と細胞周期に特異的なタンパク質の融合タンパク質は、生きた細胞でS期とG2期を観察するためのマーカーとして開発されてきた。例えば、S期に特異的に発現しDNA複製に関与する proliferating cell nuclear antigen(PCNA)、S期後期からG2期初期に発現し複製されたDNAの結合に関与するDNA ligase I、そしてS期後期に発現しDNAの二重らせんをほどいていくDNA helicase BなどのGFP融合タンパク質がこれまでに作製されてきた1,2)。しかしながら、これらのGFP融合タンパク質は、細胞内で蛍光の発現が微弱で短時間であることが多く、蛍光シグナル明暗差の検出がしばしば困難であるため、細胞周期移行を観察するマーカーとして、現時点では実用性に欠ける。
本稿で紹介する「Fucci (fluorescent, ubiquitination-based cell cycle indicator)技術」は、G1期とS/G2/M期を見分けることができる蛍光マーカーであり、細胞周期を時間空間的にリアルタイムで可視化することを可能にした3)。この技術が開発されたことにより、様々な生物現象と細胞周期の相互関係を生きた状態でリアルタイムで観察できるようになった。
この技術では、細胞周期の特定の時期だけに発現する2つの制御タンパク質であるCdt1とgeminin を利用している。これらの制御タンパク質は、ユビキチン化を介して細胞周期依存的に分解を受ける。Cdt1はDNA複製の開始因子であり、G1期に発現量が最大になりS/G2/M期には分解される。一方、gemininはCdt1機能の抑制因子であり、DNA複製を抑制している。gemininの発現はS/G2/M期に最大となりG1期には分解され存在しない(図1)。この異なる発現パターンを示す2つのタンパク質に、それぞれ異なる色の蛍光タンパク質を融合させて細胞周期マーカーを作製し、蛍光顕微鏡下の細胞の蛍光色の違いで簡単に細胞周期を見分けることを可能にした。
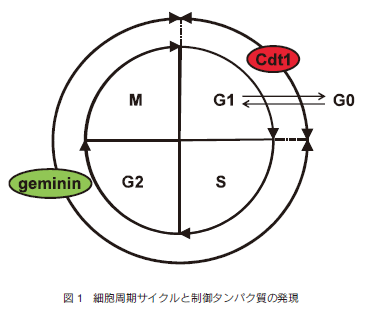
具体的には、Cdt1とgeminin の全長遺伝子を用いると細胞分裂が進行しないので、細胞分裂が進行するための最適配列を探索し、その最適配列に蛍光タンパク質を融合させている。ヒトCdt1遺伝子の部分配列にヒラタクサビライシから単離された赤色蛍光タンパク質(monomeric Kusabira-Orange 2: mKO2)の遺伝子を、ヒトgeminin遺伝子の部分配列にはアザミサンゴから単離された緑色蛍光タンパク質(monomeric Azami-Green: mAG)の遺伝子を融合させ、mKO-hCdt1と mAG-hGem を作製した。これら2つの遺伝子をレンチウイルスを使ってHeLa細胞内へ同時に導入して発現させたところ、G1期の細胞の核は赤色の蛍光を示し、S/G2/M期の細胞の核は緑色の蛍光を発することが観察された。すなわち、細胞周期に沿って赤色と緑色の蛍光が交互に出現した。この蛍光色の変化はBrdUやPCNAの免疫染色による細胞周期の分析結果と一致していた。また、Fucci (mKO-hCdt1 と mAG-hGem)
を発現させても細胞周期に影響はないことが、細胞形態の経時変化から確認された。このように、細胞周期に同期して蛍光色が交互に変化する様子が確認され、細胞周期の可視化が実現された。
Sakaue-Sawanoらは、体内においてガン細胞がどのようにふるまうかを解析するためにFucci技術を利用した。Fucciを発現する良性の腫瘍細胞塊(NMuMG細胞)をヌードマウスの乳腺上皮周辺の脂肪帯に移植して16日後の状態を観察したところ、移植細胞塊の大きさに変化はなく、赤色を呈していた。このことは、移植細胞はG1期あるいはG0期の状態となり増殖は止まっていることを示している。一方、Fucciを発現する悪性の腫瘍細胞塊(HeLa細胞)を移植した場合は、細胞塊は大きく成長し、赤色(G1期)と緑色(S/G2/M期)が混在していた。このことから、悪性の腫瘍細胞は体内で増殖が盛んであることが確認された。さらに、悪性腫瘍細胞の転移の過程における細胞周期の進行を検証するために、Fucciを発現するHeLa細胞のゲル懸濁液をヌードマウスの皮膚静脈に注入したところ、血管壁に付着した移植ガン細胞は、ほとんどすべてが赤色蛍光を発し、G1期にあることが判明した。そして、血管壁から組織内に浸潤・転移を開始したガン細胞では、赤色(G1期)と緑色(S/G2/M期)が混在した黄色の核が観察された。さらに、注入して4日後には組織内に侵入して増殖していた。これらの結果は、ガン細胞が浸潤・転移を開始するときに細胞周期の進行も開始され、組織に入った後、ガン細胞は盛んに分裂することを示している。このように、Fucci技術によって、腫瘍の悪性度の判定や腫瘍の浸潤・転移における細胞周期進行をリアルタイムに観察することも可能となった。
さらに Sakaue-Sawano らは、脳の神経組織の発生における細胞周期の進行も生きた動物を対象に解析している。赤色蛍光Fucci発現トランスジェニックマウスと緑色蛍光Fucci発現トランスジェニックマウスを交配させて、新たなFucciトランスジェニックマウスを作製した。このマウスの細胞は、すべて、赤色または緑色の蛍光を発する。このようなトランスジェニック動物は、細胞周期と神経細胞発生の相互関係を、生きた状態で検証するためには、今までにない理想的なモデルである。
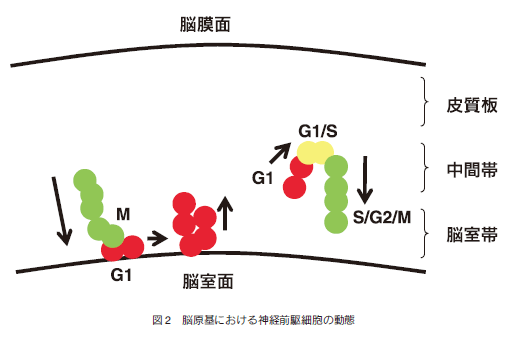
脳の神経前駆細胞のほとんどは脳室面で誕生し、その後最終配置部位へ移動し分化すると言われている。この神経前駆細胞の移動・分化が、細胞周期進行とどのようにリンクしているかを調べるために、前述のトランスジェニックマウスを利用している。神経細胞の分裂が盛んな脳原基を生きたままスライス培養して、蛍光顕微鏡で観察した。その結果、数個の細胞の動態がリアルタイムに確認された。ある動態パターンでは、脳室帯の緑色を呈する細胞(S/G2/M期)は、移動して脳室面に到達すると分裂することがわかった。その後、生じた2つの娘細胞は赤色(G1期)に変化して脳室面から中間帯へ移動することが明らかになった。また、別の動態パターンでは、中間帯にある赤色を呈する細胞(G1期)は、脳室面へ移動を開始すると同時に黄色(G1/S期移行)を経て、緑色(S/G2/M期)に変化することが確認された(図2)。このように、これまで解析が困難であった脳発生において、それぞれの細胞の細胞周期と細胞の移動・分化がどのように制御されているか、時間空間的にリアルタイムで解析することが可能となった。
Fucci技術は、生体内における細胞周期を可視化し、容易に時間空間的にリアルタイムで観察することを可能にした。今後、生体内において細胞の増殖・分化と細胞周期がどのように関係しているのか更に明らかになると考えられる。この技術によって、細胞周期の制御が深く関わっているガン細胞の浸潤・転移や、再生医療に重要なiPS細胞の分化などと細胞周期進行を関連させて評価することが可能である。さらに、創薬分野で細胞増殖に関わる薬の評価に利用できると期待される。
今回紹介したFucci技術では、細胞周期のG1期とそれ以外のS/G2/M期を識別する2種の蛍光マーカーを用いている。今後、各々の期に特異的な蛍光マーカーが開発され、細胞周期の進行がより詳細に明らかにされることを期待したい。
▲ページのトップへ
参考文献
1) H. Leonhardt, H. P. Rahn, P. Weinzierl, A. Sporbert, T. Cremer, D. Zinkand
M. C. Cardoso, J. Cell Biol., 2000, 149, 271.
2) H. P. Easwaran, H. Leonhardt and M. C. Cardoso, Cell Cycle, 2005, 4, 453.
3) A. Sakaue-Sawano, H. Kurokawa, T. Morimura, A. Hanyu, H. Hama, H. Osawa, S. Kashiwagi, K. Fukami, T. Miyata, H. Miyoshi, T. Imamura, M.
Ogawa, H. Masai and A. Miyawaki, Cell, 2008, 132, 487.
▲ページのトップへ
|



