「蛍光生物学」の最前線 1
生体機能イメージングを実現する蛍光プローブの精密設計
神谷 真子 ・ 浦野 泰照
東京大学大学院医学系研究科 |
1.はじめに
小学校の理科で誰もが一度は触れたことがあるであろう、pHによるBTB溶液の色の変化、さらし粉によるアニリンの呈色、ヨウ素によるでんぷんの呈色反応。pH、アニリン、でんぷんといった直接目で観察することの出来ない分子が、BTB溶液・さらし粉・ヨウ素といった試薬を加えるとなぜか特定の“色”に変化し視覚的に確認できるようになる……そんな現象に感動を覚えた方も少なくないだろう。これらは特定の条件下になると色が変化する原
理を用いた検出法だが、色の変化の代わりに、特定の条件下でのみ“蛍光”を発するような試薬も知られている。“蛍光プローブ”と呼ばれるこれらの試薬は、より高感度な検出が可能であるため、試験管の中だけでなく「生きている状態の生物試料」における種々の生理活性物質の動態をリアルタイムに観測する研究ツールとして、現在の生物学的研究には欠かせないものとなっている。「蛍光生物学」の最前線の第一回目である今回は、このような蛍光プローブの特徴や開発の経緯、また筆者らが確立してきた蛍光プローブのオリジナル設計法および本設計法に基づき開発した種々の蛍光プローブを紹介していきたいと思う。
2.蛍光プローブとは
では、蛍光プローブとはどのような機能や特徴を持った分子なのだろうか? 図1(a)に、蛍光プローブを用いて「生きている」細胞を「生きたまま」観測する手法の原理を簡潔にまとめた。観測対象とする生理活性分子(▽)の検出を考えるとき、ほとんどの生理活性物質は無色であるため、光学顕微鏡でただ観察してもその動きを知ることは出来ない。そこで、元々は無蛍光性であり、▽と反応・結合することで初めて蛍光を発する分子(蛍光プローブ)を細胞内に存在させることで、▽の動きを蛍光の変化として、高感度かつリアルタイムに追うことが可能となる。このように、簡便かつ高感度に観測対象分子を可視化する蛍光プローブは、現在の生命科学研究や医学・薬学研究において欠かせないツールとなっている。
その端緒となったのが、1980年にTsienらにより開発された、Ca2+イオン蛍光プローブの開発であった1-3)。現在では、Ca2+イオンが細胞内の情報伝達を司る代表的なセカンドメッセンジャーとして働いていることは、既に疑いの無い事実であるが、これはCa2+イオンを高感度かつ迅速に蛍光検出可能な蛍光プローブの開発によるところが極めて大きい。代表的なCa2+イオン検出蛍光プローブであるFluo-3の構造とCa2+イオン検出の原理を図1(b)に示した。Fluo-3はフルオレセイン骨格とCa2+イオンキレーターであるBAPTA部位とが融合した構造であるが、Ca2+フリーの状態ではほぼ無蛍光であり、これがCa2+イオンと結合することでその蛍光強度が36-40倍に上昇する性質を持つことから、生細胞におけるCa2+イオンの挙動を初めて詳細に検討することが可能になったのである。
▲ページのトップへ
3.分子内光誘起電子移動に基づく蛍光プローブの論理的精密設計法の確立
上述のように生細胞観測に極めて重要な役割を果たす蛍光プローブであるが、これまでに開発されてきた有機小分子蛍光プローブのほとんどはtrial and errorで開発されてきており、望みの機能を実現する蛍光プローブを狙って開発することは極めて困難であった。
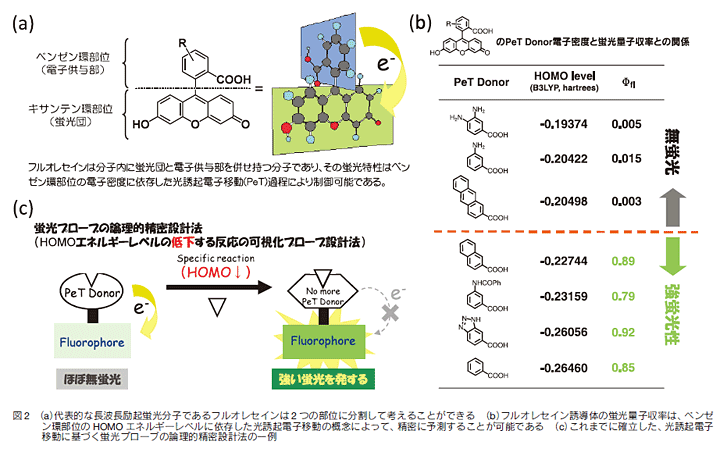
そこで筆者らはこのような状況を打破し、目的の機能を有する蛍光プローブを論理的に精密に設計することを目標とした研究を行ってきた結果、光誘起電子移動(Photoinduced Electron Transfer; PeT)を設計原理とする蛍光プローブの論理的なデザイン法を確立することに成功した。すなわち、例えば代表的な蛍光分子であるフルオレセインは、分子をベンゼン環部位と蛍光団であるキサンテン環部位の2つに分けて考えることが可能であり、分子内PeTによりその蛍光特性を精密に制御可能であることを見出した(図2(a))。具体的には、ベンゼン環部位のHOMOエネルギーレベルがある値よりも高いフルオレセイン誘導体は全てほぼ無蛍光であり、これが低い誘導体は全てフルオレセインと同等の強い蛍光を発することが明らかとなった(図2(b))4,5)。
以上の知見を発展させることで筆者らは、図2(c)に示した蛍光プローブの論理的設計法の確立に成功した。すなわち、ある観測対象分子に対する蛍光プローブの開発を考える際、その観測対象分子と特異的に結合・反応し、かつその反応前後で基質のHOMOエネルギーレベルが大きく低下する化学反応(分光学的な変化は一切必要ない)さえ知っていれば、これを活用して反応前はPeTによりほぼ無蛍光であり、反応後にPeTが起こらなくなることで強い蛍光を発するプローブを論理的に開発することが可能となった。
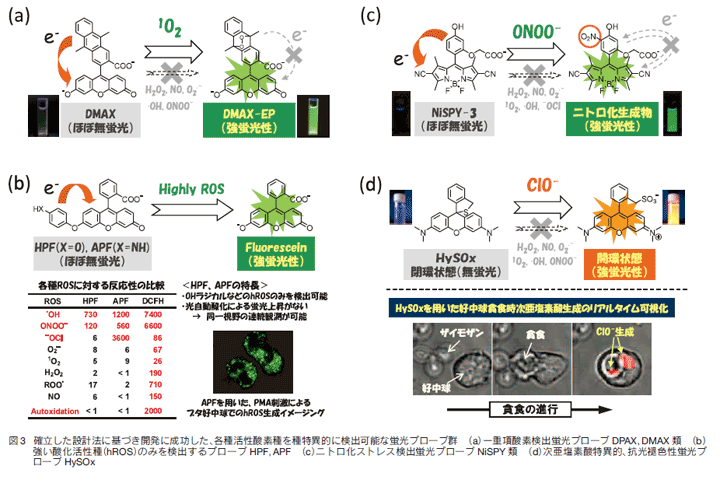
そこでまず筆者らは、上述の蛍光プローブデザイン法を活用して、各種活性酸素種(ROS)の選択的検出を可能とする蛍光プローブの開発を試みた。活性酸素種(ROS)は、炎症、ガンなど多くの疾患に関わるとされ、また近年では細胞内情報伝達物質としての役割も持つとの指摘もあり、ますます注目を集めている。一口にROSと言っても、スーパーオキシド、過酸化水素、ハイドロキシルラジカル、一重項酸素など多くの種が存在し、これらはそれぞれ特徴的な化学反応性を持つことから、生体内においても異なる役割を持つ可能性も高い。ROS検出用蛍光プローブは、筆者らの研究以前にもいくつか開発され、中でもジクロロフルオレセインの2電子還元体であるDCFH(Dichlorodihydrofluorescein)が広く用いられてきた。しかしながらDCFHにはROS間の特異性は全くなく、また励起光を当てるだけでROSの有無にかかわらず大きく蛍光が増大してしまう欠点を持っており、生物学的に意味あるデータを得ることは困難であった。そこで筆者らは、ある特定の活性酸素種のみを検出可能な蛍光プローブの精密設計を試みた結果、多数の新規蛍光プローブの開発に成功した6-9)。図3にいくつかの代表例を示したが、例えば一重項酸素とパーオキシナイトライトとをそれぞれ高選択的かつ高感度に検出可能な蛍光プローブは、前者はアントラセンからエンドパーオキサイドを生成する化学反応5,6)を、後者はフェノールのニトロ化反応8)をそれぞれ鍵化学反応として活用することで、論理的にそれぞれの蛍光プローブを開発することに成功した。
▲ページのトップへ
4.TokyoGreen骨格の創製に基づく、各種加水分解酵素活性可視化蛍光プローブの開発
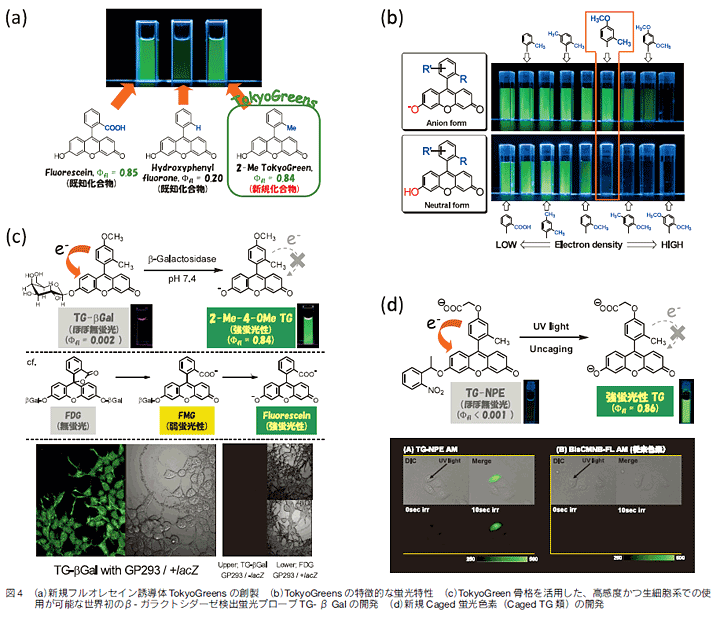
さらに最近、フルオレセインの骨格構造を大胆に見直すことで、新たな蛍光プローブデザイン法に繋がる誘導体群の創製に成功した。すなわち上記のPeTの考え方によれば、カルボキシ基は他の官能基に変換することが可能なはずであると考え、メチル基、メトキシ基など他の官能基に置換した誘導体の開発に成功した(図4(a))。驚いたことにこれらの単純なフルオレセイン誘導体は新規化合物であり、また以下に詳述するようにこれらは極めて有用な蛍光プローブ母核となるものであったため、これらの新規蛍光骨格をTokyoGreen(以下TGと略す)と命名した10)。次にこれらTGsの蛍光特性を精査した結果、ベンゼン環HOMOエネルギーレベルの上昇により蛍光量子収率が減少するというPeTの原理に一致した結果が得られたばかりでなく、蛍光On/Offの境界はキサンテン環部位の水酸基がアニオン型である場合と、分子型である場合で大きく異なることも明らかとなった(図4(b))。本知見はプローブ設計の観点から非常に有用である。すなわち、図4(b)のオレンジの枠で囲ったm-メトキシトルエンをベンゼン環部位として持つTGは、キサンテン部位がアニオン型の時は強蛍光性である一方、分子型になるとほぼ無蛍光であるという特異な性質を有するキサンテン系色素と考えられ、極めて有用な蛍光プローブ母核となり得ることを示している。以下、本特性を活用して開発に成功した各種加水分解酵素活性を可視化する蛍光プローブを紹介する。
まず、レポーター酵素として汎用されているβ-ガラクトシダーゼ活性検出蛍光プローブTG-βGal(図4(c))を紹介する。TG-βGalは、m-メトキシトルエンをそのベンゼン環部位とするTG類であり、このプローブ自身のキサンテン環部位の水酸基は、ガラクトースと結合しているエーテル構造となっており、よってpH7.4の水溶液中でも分子型をとる結果、ほぼ無蛍光性である。これがβ-ガラクトシダーゼにより特異的に加水分解されることで、キサンテン環部位の水酸基はフリーとなるが、そのpKaが約6.2であるため脱プロトン化してアニオン型となるため、生成物である2-Me-4-OMeTGは強い蛍光を発する。すなわち本プローブはβ-ガラクトシダーゼ活性検出蛍光プローブとして機能する。実際、本反応前後での蛍光増大率は約800倍にも達し、極めて鋭敏にβ-ガラクトシダーゼ活性検出が可能である。また、本プローブは生細胞系への適用が可能であり、実際図4(c)に示したように、生細胞系におけるβ-ガラクトシダーゼを高感度に検出することが可能である10,11)。
上述の設計法で用いるアルキル基部位は、もちろんガラクトースに限られるものではない。これを光解除性保護基であるニトロベンジル基とすれば、いわゆるCaged蛍光色素が誕生する。実際本設計法に基づいて開発されたTG-NPEは、それ自身は分子内PeTの結果ほぼ無蛍光であり、ここに350nmの解除光を照射することで大きな蛍光増大を示すCaged蛍光色素として機能する。TG-NPEは上述のTG-βGalと同様、1段階の光解除性保護基の脱離により最大の蛍光強度変化を生じるため、従来色素に比べ極めて短時間の解除光照射で単一細胞の蛍光染色が可能であることも示された(図4(d))12)。
▲ページのトップへ
5.空間局在の制御が可能な蛍光プローブ
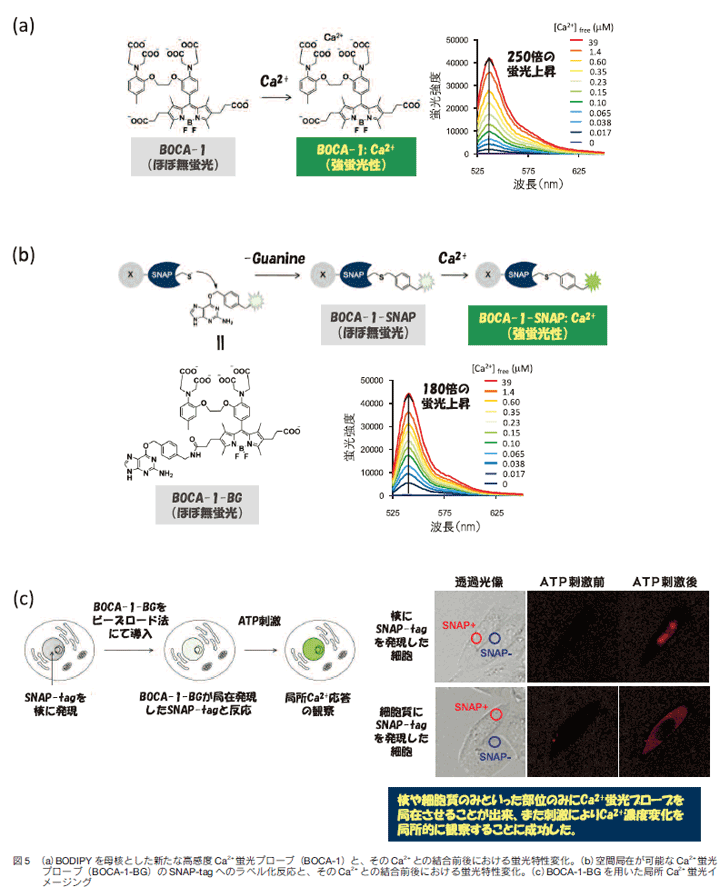
上述のように、筆者らの確立した蛍光プローブ設計法により、望みの機能を持つ蛍光プローブを狙って開発することが出来るようになってきた。一方で近年では、蛍光プローブと、FlAsH-tag、Halo-tag、SNAP-tagといった蛋白ラベル化技術とを組み合わせることで、蛍光プローブの細胞内局在を制御しようという試みが報告されている13-15)。筆者らも、独自の蛍光プローブ設計法により新たな高感度Ca2+蛍光プローブを開発し、SNAP-tagと組み合わせることで、部位特異的なCa2+挙動の観察に成功したので下記に紹介する。
まず初めに、筆者らの方法論に則りプローブ骨格の最適化を図ることで、既存のCa2+蛍光プローブよりも大きな蛍光上昇を示すプローブを設計した。具体的には、tetramethyl BODIPYを基本蛍光骨格として、Ca2+キレーターであるBAPTAを適切に配置させることで、従来までの蛍光プローブでは成し得なかった250倍という蛍光強度上昇を示す新たなCa2+蛍光プローブ(BODIPY basedcalcium indicator, BOCA-1)の開発に成功した(図5(a))。
次に、開発したBOCA-1に、SNAP-tagとの反応部位であるbenzylguanineを組み込んだ化合物(BOCA-1-BG)を合成した。BOCA-1-BGのSNAP-tagとのラベル化後における蛍光特性を精査した結果、Ca2+添加により180倍もの蛍光強度上昇を示し、蛋白とのラベル化後にもその機能が保持されることが示された(図5(b))。
さらに、SNAP-tagを細胞内の特定の部位(核・細胞質)に局所発現させた細胞を用い、BOCA-1-BGの生細胞における局在性・応答性を検討した。ビーズロード法16)により化合物を細胞内に導入したところ、SNAP-tagが発現している部位のみにCa2+蛍光プローブを局在させることが出来、またATP刺激によりCa2+濃度変化を局所的に観察することに成功した(図5(c))17)。このような局所Ca2+濃度変化を可視化する手法の開発により、細胞内シグナル伝達におけるCa2+の担う役割について、より深い洞察および新たな知見がもたらされるものと考えている。
6.おわりに
筆者らが確立することに成功した有機小分子蛍光プローブの論理的な設計法により、開発可能な蛍光プローブの種類は飛躍的に増大し、実際、本稿で紹介してきたように、生きている生物試料の中で起こる各種イベントを可視化する、実用性のある新規蛍光プローブ群の開発に成功してきた。今後、これらのプローブをより現場の要望に応じたプローブへと育てていくとともに、新たな機能を持つプローブを開発していく予定である。
また今回は紹介できなかったが、筆者らは、従来培養細胞系が主な対象であった蛍光プローブをin vivoにも適用することで、極めて高精度なin vivoがんイメージングへと適用拡大することにも成功している。興味のある方は筆者らの総説などを参照して頂ければと思う18,19)。
▲ページのトップへ
| 筆者紹介 |
 |
| 氏名 |
神谷 真子(Mako KAMIYA) |
| 連絡先 |
東京大学大学院医学系研究科・生体情報学分野・助教
〒113-0033 東京都文京区本郷7-3-1
Tel:03-5841-3568 Fax:03-5841-3563
E-mail:mkamiya@m.u-tokyo.ac.jp |
| 略歴 |
2008 東京大学大学院薬学系研究科博士課程終了(薬学博士)
2008-2010 スイス連邦工科大学ローザンヌ校 博士研究員
2010 現職 |
 |
| 氏名 |
浦野 泰照(Yasuteru URANO) |
| 連絡先 |
東京大学大学院医学系研究科・生体情報学分野・教授
〒113-0033 東京都文京区本郷7-3-1
Tel:03-5841-3601 Fax:03-5841-3563
E-mail:uranokun@m.u-tokyo.ac.jp |
| 略歴 |
1995 東京大学大学院薬学系研究科博士課程終了・博士(薬学)
1995-1997 日本学術振興会特別研究員(PD)
1997-2005 東京大学大学院薬学系研究科 助手
2004-2008 科学技術振興機構さきがけ「構造機能と計測分析」
領域研究員(兼任)
2005-2009 東京大学大学院薬学系研究科 助教授・准教授
2010 現職 |
| 現在のテーマ |
光機能性小分子群の創製・癌のin vivo蛍光イメージング |
▲ページのトップへ
|