 |
| トップページ > GABA合成酵素グルタミン酸デカルボキシラーゼにみる隠れた機能:味覚での役割と応用 |
 |
|||||||||||||||||||||
GABA合成酵素グルタミン酸デカルボキシラーゼにみる隠れた機能:味覚での役割と応用
1.はじめに グルタミン酸の代謝酵素の一つにグルタミン酸デカルボキシラーゼ(GAD)がある。GADは高等動物の中枢神経系に多く発現し、抑制性神経伝達物質であるγ-アミノ酪酸(GABA)を合成する酵素として発見された1-3)(図1)。当時、活発に研究がなされて、生体での局在性などの研究もなされ、その結果、脳、膵臓、精巣に発現することが報告されている。このような初期の研究成果がもたらした功罪であろうか、それ以降GADの研究は中枢を主体とするものであった。高等動物以外でもGADの存在が知られている。
大腸菌、トマトやホウレンソウなどからGADが精製された4)。しかし、神経組織を持たない大腸菌などでのGADの役割は長いこと不明であったが、酵素学的な性質の解明は大腸菌酵素の研究に負うところが多かったのである。この分野で大きな曲がり角となったのは1990年初頭である。その年には、高等動物のGAD遺伝子が同定され、二つの独立した遺伝子の存在が明らかになったこと5)、そして、その内の一つ(GAD65)が 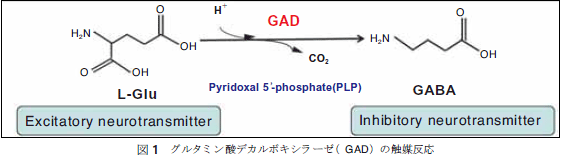 2.GADの高等動物から微生物グルタミン酸デカルボキシラーゼ(GAD)は、ビタミンB6関与の脱炭酸酵素である。 アミノ酸配列は遺伝子解析より予想された配列が知られており、ヒスチジンデカルボキシラーゼ(HDC)と芳香族アミノ酸デカルボキシラーゼ(古くはDOPAデカルボキシラーゼ)(ADC)と同じ部類に分類される。 ゲノム解析の結果、ほぼすべての生物体にGADと類似のアミノ酸配列をもつタンパク質の存在が予想されている。アミノ酸配列は遺伝子解析より簡便に予想できる。しかし、タンパク質レベルから配列決定した結果、遺伝子解析からの予想とは異なる残基(多くは翻訳後修飾)の存在や、成熟化機構などによるN末端やC末端領域の切断機構などは分からないままなので、タンパク質レベルでのアミノ酸解析は必ず考慮すべきである。GADにおいては、まだタンパク質レベルでのアミノ酸配列解析は行われていない(一部、活性中心のアミノ酸配列は報告されているが)。 高等動物のGADは1950年代にその存在が分かり、神経伝達物質であるGABAの合成を担うことより重要度が認識され、多くの酵素的性質を明らかにする研究がおこなわれてきた。精製も活発に行われてきたが、分子量やサブユニット構造に関しては統一した見解が得られずにいた7)。1990年になって、GAD遺伝子のクローニングがなされ、異なる染色体上に独立した遺伝子としてGADが2つ存在することが判明し、それぞれをアイソフォームと呼ぶことになった。合成されるタンパク質の分子量が65kDaと67kDaであることよりそれぞれのアイソフォームはGAD65とGAD67と命名される。 GAD遺伝子は16個のエクソンで構成され、エクソン・イントロンの境界は動物種をまたがったGAD間でも、同一の動物種のアイソフォーム間でも類似している(図2)。タンパク質レベルでの相同性は、アイソフォーム間では60%程度であるが、種を超えた同一のアイソフォーム間では80%以上と高い。脱炭酸酵素としての機能には、補酵素であるピリドキサル5’リン酸(PLP)と結合してシッフ塩基をつくるLys残基、α位のカルボン酸を認識するアミノ酸残基(Argとされる)、そして、側鎖のカルボン酸を認識するアミノ酸残基(Argであろう)が必要とされる。N末端100残基を欠失したX線結晶構造が近年報告され8)、アミノ酸基質認識に関与するこれらの残基はN末が欠損した残りの部位(C末端領域)に存在することが判明した。これにより、GADの場合、N末100残基がなくても活性がフルに表現できることが判り、なぜN末端領域100残基が必要なのかというN末端領域の意義が反対に問われることになった8)。興味深いことに、GAD,HDCとADCのアミノ酸配列の相同性を比較すると、ADCが一番短くてちょうどGADがN末100残基を失った部分に相当する。また、GADはN末に約100残基長く、HDCは反対にC末が約150残基長い。近年、HDCは成熟化機構により、C末約150残基が切断除去されることで活性型に変化することが判明し、上述のGADのN末欠損型が活性をフルに保持していることと辻褄があう。これらをまとめると、ADCが一番古い形の脱炭酸酵素であり、その後、GADとHDCに進化したことが想像できる。 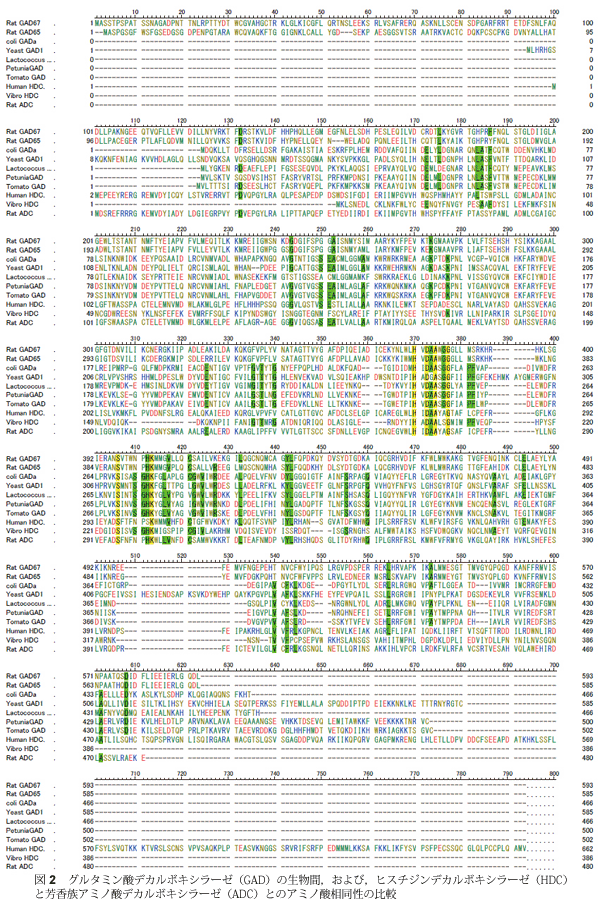 GADアイソフォームの役割解明は現在活発に進められている。触媒作用部位であるN末端100残基を除いた領域は、部位特異的な発現様式やアイソフォームの違いを説明するには酷似しているため、N末端領域に秘密が隠されているというのが一般的な考えである。GAD65のN末にはCys残基が3箇所存在し、ガン分野で知られているRasタンパク質内のCys残基と同様にpalmitoyl化されていることが報告されている9-11)。GAD65は膜親和性が高く、GAD67はほとんど膜との親和性がないことが知られているので、palmitoyl化は膜親和性に関与すると想像されたが、部位特異的突然変異法でCys残基を他のアミノ酸に置換しても膜親和性に変化がなかったという報告がなされており、まだ完全には理解されていない。GADはビタミンB6酵素では珍しくリン酸化される11,12)。リン酸化により活性化、脱リン酸化により不活性化が起きるが、GAD65とGAD67ではリン酸化による活性制御機構が逆転しているという報告がある。小幡らはノックアウトマウスを作製し、GADアイソフォーム間の違いを示した。GAD65ノックアウトマウスでは、生後発作を頻繁に起こし、短命で終えるが、GAD67ノックアウトマウスでは、上あご形成不全という発生異常で生後すぐに呼吸不全で死ぬことが分かった13,14)。これにより、GAD65は神経終末での小胞体関与が、GAD67は細胞質での代謝に何らかの役割を担っていると判断され、アイソフォーム間の役割分担がなされていることが分かる。ちなみに、LDHなどの「アイソザイム」は臓器ごとに発現するサブユニットの比率がM4,M3H,M2H2,MH3,H4という具合に異なるのとは違い、GADアイソフォームでは、同一の細胞にて同時に2種類のGADが発現し、それぞれ異なる役割を担っているという特徴がある(図3)。 それでは、どちらのアイソフォームもグルタミン酸を基質としGABAを生成する化学反応を触媒する訳であるが、細胞内では、基質であるグルタミン酸分子はどのような取り分けがなされるのであろうか?また、グルタミン酸分子の供給経路に関しても大きな関心が寄せられているが、まだ理解されているとは言えない。 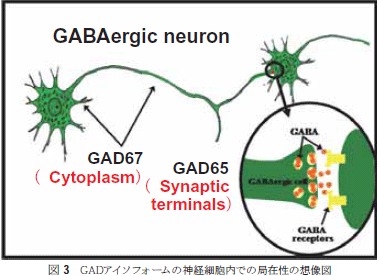 GADが発生や発作に関与する以外に、糖尿病などの疾患にも関与することが報告されている。
GADは高等動物以外でも多くの生物が備えていることがゲノム解析の結果理解されてきた。GADが存在することは、すなわちGABAの存在も意味し、そこで生じる大きな疑問は、神経伝達物質であるGABAは、神経組織を持たない非神経系組織や細胞でどのような役割をしているのか?である。植物体は6量体タンパク質であるGADを発現するが、一部ではC末端領域が長く、その部分にカルモジュリン結合部位を持つことが報告されている。植物体でのGABAの役割はまだ検討すべき課題であるが、GABA合成機構がCa++イオンにより制御されていることは興味深い。微生物界ではGADはほぼすべてにおいて存在が確認されている。 特に興味深いことは,複数の遺伝子が備わっていることと、産生されるタンパク質のサブユニット構成であろう。 表1に示すように、大腸菌(E.coli)ではGADAとGADBの2種が、麹菌ではGAD1~8の8種が、キノコ(C.cinereus)では2種という具合に複数個のGAD遺伝子の存在がゲノム解析の結果明らかになっている。また、サブユニット構成に関しては、大腸菌やパン酵母(S.cerevisiae)は6量体、乳酸菌は2量体という報告があるが、他の微生物由来のGADに関しての報告は少ない。多量体サブユニット構造をもつGADの酵素学的・生理学的研究はほとんどなされておらず、今後の課題とも言える。 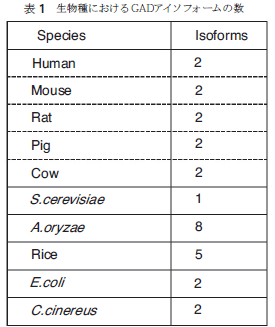 古くより大腸菌由来のGADの研究は活発になされていたが、神経組織を持たない微生物におけるGADの役割は理解されてこなかった。しかし、近年、GADおよびGABAが酵母においては抗酸化機構に、大腸菌や乳酸菌では酸耐性機構に関与するとの報告がなされ、新たなるGADの役割が明らかになってきている15-18)。
3.グルタミン酸デカルボキシラーゼの味蕾での発現GADの非神経系組織での局在化に注目されている。近年、食の分野ではGABAが特保に認定され、GABA入りのチョコレート、ヨーグルト、味噌汁、飲料水を始めさまざまな製品が開発されて販売されている。GABAの生理効果は、血圧上昇抑制、利尿作用や成長ホルモンの誘発による細胞の活性化といった生活習慣病予防やリラクゼーション効果をうたっている。ところが、生体内での作用機序がまだ完全に理解されておらず、基本的なGADの局在性の検討が必要になっている。 従来、高等動物ではGABAの働きは神経伝達作用に注目され、脳の他では高い発現レベルを観察される膵臓や精巣が主たる研究対象であった。ところが非神経系での働きに注目がいくことで、他の臓器での局在性を知る必要があるが、ほとんど理解されていない状態であった。そこで当研究室では、組織免疫化学染色法を用いて舌下腺、皮膚、胃、腸でのGADの局在性を京都府立医科大学河田光博教授、一丸ファルコス(株)長谷川順一・伊藤賢一博士らとともに検討し、これら臓器にGADの発現を報告してきた19-22)。また、分子生物学手法であるRT-PCRによりmRNAの存在も明らかにした。これまで酵素の組織における局在性の研究は数多くなされてきたが、酵素学的な見地での検討は少ないと考えられる。それは、酵素反応を行うに必要な基質濃度、つまりKm値を考慮した基質レベルでの酵素の分布を考えるということである。実は、細胞内での基質の濃度分布を正確に測定することは大変困難である。これにより、通常は、基質濃度を考えずに酵素タンパク質の存在の有無を検討することになる。GADの場合、基質であるグルタミン酸が基質レベルで存在する部位といえば、口腔内であろう。グルタミン酸(グルタミン酸ソーダと同義に使う)は、100年前に池田菊苗博士が昆布から抽出したうま味物質である。グルタミン酸ソーダの結晶である「味の素」をふりかけた食材を口にしたりすると、口腔内には基質レベルのグルタミン酸が存在することになる。人体では、大量のグルタミン酸を単にうま味物質としてうま味受容体と結合し、その信号を脳に送ってうま味を認識するだけに用いて、残りのグルタミン酸は機械的に胃や腸に送りこんでいるだけであろうか?グルタミン酸は何か他にも目的があって使われるということを考えた場合、代謝酵素の存在の有無を検討することは一つの要点ではないかと考えた。 我々は舌にはGAD抗体により染色される部位が存在し、それが味蕾であることを見出し、RT-PCRにてもGADの発現の可能性を検討してきた。その折、生理学研究所の小幡邦彦教授と柳川右千夫助教授が作製されたGAD67/GFPノックインマウスに出会うことになった23,24)。大阪医科大学渡辺正仁助教授との共同研究にて、味蕾でのGAD67の発現を検討してきたので、ここで紹介する。それにあたり、まずは、基本的な味蕾の仕組みについて触れておこう。 ヒトの場合、舌には有郭乳頭、葉状乳頭、耳状乳頭、糸状乳頭という4種類の乳頭があり、そのなかで糸状乳頭だけが味を感じる味蕾を持たないとされる。一般に一つの乳頭の中には数百といわれる細長い味蕾が集まっており、その様子は玉ねぎのようである。細長い味蕾細胞の形は特徴的で、乳頭から取り出すと球状の通常の形に戻ることより、形態の形成機構に関連した研究は現在活発になされている状態である。また、細胞の寿命も10日と短いといわれており、早いターンオーバーと味の感知能力・記憶との関係などもまだまだ解明すべき課題は多いとされる。乳頭の位置関係は顕微鏡観察によりマッピングがなされているが、乳頭自身はすべての味質(五味)を感知できるとされている。味を実際に感知する部分は、味物質との結合部位をもつ受容体が担っている。現在、ゲノム解析が完了したことにより、味物質と結合する受容体が遺伝子レベルで分かっており、代表的な受容体は培養細胞に発現させて味物質との応答機構を検討できるようになっている。 ヒトの五味は、「甘味」「苦味」「うま味」「酸味」「塩味」とされる。甘味・苦み・うま味受容体はGタンパク質共役型受容体(GPCR)であり、典型的な膜貫通型のヘテロ二量体タンパク質である。酸味と塩味はリガンド結合型イオンチャンネルで、複合体タンパク質で構成されている。GPCRの場合は、多種にわたるリガンド(味物質)が細胞外に表現されている部分に結合し、その結合が味の情報として細胞内に伝達され、細胞内のリン酸化カスケードを活性化することで次々と情報伝達される。リガンドの結合は、細胞内のCa++濃度を変化させ、また電気信号の電位差を生じさせることも研究されている。味蕾にはGPCRを発現させている GAD67/GFPノックインマウスの舌にUVライトを照射すると、中央に強い緑色に光る部分が観察できた(図4)。この部分は、マウスに一か所存在する有郭乳頭であり、縦にスライスした切片を蛍光顕微鏡観察すると、細長く緑色に発色する細胞が観察され、味蕾であると判断できた。抗GABA抗体と抗
GAD67抗体で染色される細胞と蛍光発色する細胞との重ね合わせにより、蛍光を発する細胞はGAD67を発現し、GABAを産生することより、細胞内ではGADは活性型で発現していること、生産されたGABAは何らかの生理作用をもつことが想像できた。蛍光を発する細胞を指標として、さらに詳細な検討が可能となったが、まずは、味蕾細胞の種類を決定する作業に入った。 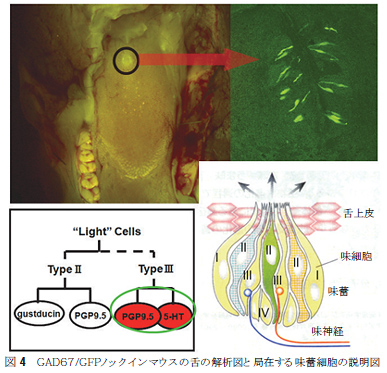 GABAの情報伝達機構の解析より、GABAにはGABAA、GABAB、そしてGABACの3種類の受容体が知られている。その中で、GABAAとGABACはクロライドイオンチャンネル型受容体であり、GABABはGPCR型であることが知られている。クロライドイオンチャンネル型受容体は5つのヘテロサブユニット構造をとるが、各サブユニットにはα1~6,β1~4,γ1~4,σ,ε,ρ1~4が準備されており、少なくともαとβは1個づつ備わっていると考えられている。味蕾の蛍光発色部分を切り出し、mRNA抽出後cDNA化し、RT-PCRによりサブユニットの存在を探索すると、GABA受容体に相当するサブユニット群の存在を明らかにすることができた(未発表)。これらの結果より、味蕾にてGABAが合成され、GABAをリガンドとしたクロライドイオンチャンネルもしくはGABA受容体の活動が想定できることになる。 4.官能試験によるGABAの効果をみる 我々は、GABAが味蕾で発現することで、はたして味覚への関与はあるのか?という疑問に答えるために、官能試験による検討を行った。一般に味覚のような個人差もある感覚機能を定量的に評価することは困難である。ましてや、動物実験では得ることができない。まずは、GABAそのものが味質を呈するのか否かを検討したところ、無味無臭と思われたが、多くが酸味に近い味を感じ、苦み、塩味、甘味の順で味質を表現している。また、基本五味に与える影響では、GABAの添加で塩味とうま味が強調される傾向にあることが判明した29,30)。GABAが これまで塩味はNaClのうち、Na+が主たる役割を担っていると考えられたが、NaClとNaIでは味質が異なるという報告などがあり、クロライドイオンの効果は否定できない。そこで、味蕾細胞内でのGABAの働きをさらに明らかにする一端として、GABA合成システムに揺らぎを与えることを計画した。つまり、GABA合成酵素であるGADの活性に変化を与える物質の味覚への効果を検討することにある。その第一歩として、組換え体GADタンパク質の酵素活性への香辛料抽出物の効果を検討した(図5)。 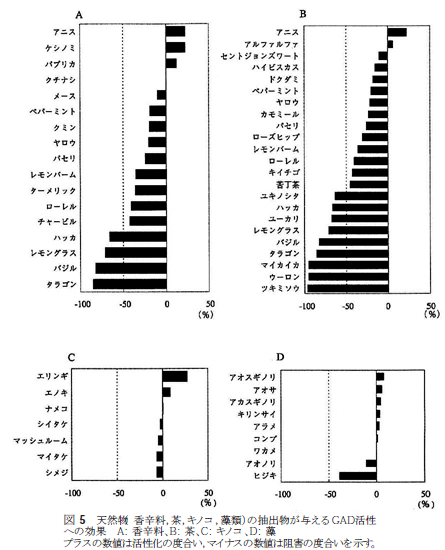 GADを大腸菌もしくはパン酵母に組込み、誘導発現させた組換え体タンパク質を用い、香辛料や生薬の抽出物がどのようにGAD活性に影響するかを検討した。その結果、これら天然物抽出物はGAD活性を大きく阻害したり、活性化することが判明した。この結果は少なからずの驚きである。我々が口にする食材の成分には、GABA合成に関わる酵素の活性に多様な影響を与えるというものである31,32)。GADの局在性が味蕾、胃、腸など食成分と直接接する部位であることを考慮すると、GABA量の変動が細胞レベルで何らかの効果(腸の運動、ホルモンや胃酸分泌など)を示す可能性を示唆する。もちろん、今後、実験的に証明してする必要はあるが、まだまだ研究が進んでいない領域のように思える。 図6には、 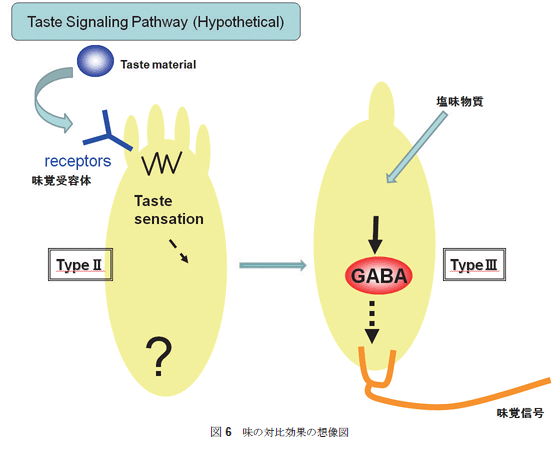 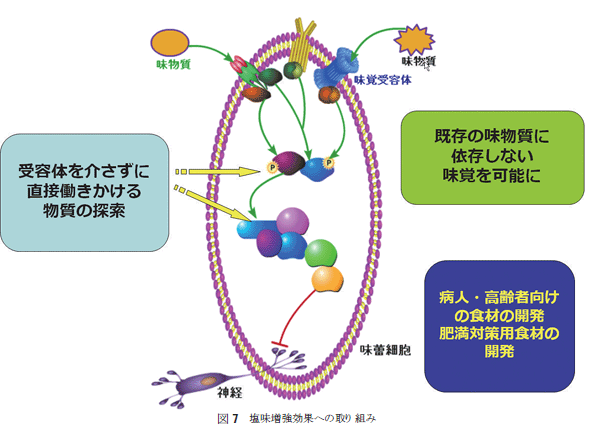 5. おわりにGADの酵素としての反応機構に興味をもって大腸菌由来のGADの自殺基質の研究から研究生活に入ったが、その後、遺伝子工学の技術を用いることで高等動物由来のGADの酵素学的研究が可能になり、さらに、抗体やRT-PCRの技術が使えるようになったことでいろんな臓器や細胞でのGADの局在化の検討をおこなえるようになった。その結果、今回は紹介できなかった血球におけるスプライシング異常の現象を見出すなど、GADには多くの謎めいた現象が付きまとっているようである。今回紹介した味覚との関係は、現在、細胞内でのタンパク質間相互作用としていくつかの非常識?と思えるGAD・タンパク質間相互作用を観察するに至っている(未発表)。GABAを産生する酵素としてだけでなく、いろんな角度からのGADの働きに注目してしばらく活動したい。 謝辞 本研究を進めるにあたり共同研究していただいた大阪医科大学渡辺正仁博士、生理学研究所小幡邦彦博士、柳川右千夫博士、京都府立医科大学河田光博博士、一丸ファルコス(株) 長谷川順一博士、伊藤賢一博士に感謝申し上げたい。
|
|||||||||||||||||||||
| Copyright(c) 1996-2010 DOJINDO LABORATORIES,ALL Rights Reserved. |

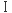 型糖尿病患者に発現する自己免疫抗体の標的抗原であることが判明した
型糖尿病患者に発現する自己免疫抗体の標的抗原であることが判明した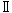 型細胞、イオンチャンネルを発現させている
型細胞、イオンチャンネルを発現させている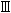 型細胞の他に、細胞同士を保持させる
型細胞の他に、細胞同士を保持させる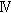 型細胞に大別され、一つの乳頭には
型細胞に大別され、一つの乳頭には