I. はじめに
イムノアッセイは、免疫反応を利用して、微量物質の検出・定量を行う手法で、特異性が高く高感度な分析方法である。酵素免疫測定法(EIA: enzyme-immuno assay)、免疫染色法、イムノブロッティングなど応用の幅も広い。ELISA(enzyme-linked immunosorbent assay)は、EIAの中でも特によく用いられる手法である。これらの手法は、酵素反応や蛍光検出系を組み合わせることで、従来の手法でよく用いられた放射性物質を用いる必要がなく、取り扱いの制約や危険性も低い検出系として、よく利用されている。
抗原と結合したモノクローナル抗体やポリクローナル抗体(一次抗体)を検出するには、標識された二次抗体を使用するのが一般的である。ビオチン、酵素、蛍光色素などが標識された二次抗体は、市販されていることが多く、使用者が使用する一次抗体に適した二次抗体を用いれば、吸光、蛍光、発光などの検出に応じた系を選択することが可能である。
一方、酵素やビオチンなどを一次抗体に直接標識することが可能であれば、実験手順は簡略化され、さらに多重染色への発展、二次抗体の影響の回避など多くの利点がある。それにもかかわらず、一次抗体への直接標識法が広く普及していない背景には、標識操作の煩雑さや得られる標識抗体の活性低下などの問題点がある。抗体に直接標識する技術は研究室によっては実施しにくく敬遠される場合も多い1)。
しかし、特異性や活性を損なうことなく抗体へ直接標識することが簡便化されれば、先に述べたような利点を生かすことができる。また、抗体以外のタンパク質を同様に標識することができれば、この手法はタンパク質が関与する相互作用の解析など応用が可能である。 本誌では、小社のキットの原理を中心に、抗体の特異性を失うことなく抗体へ酵素(タンパク質)を簡便に標識できる方法や、その実験例などを初心者の方にも分かりやすくご紹介したい。
III. 何を標識するのか
測定方法に応じて、標識分子の種類は異なる。主な標識分子の種類を以下に示す。
| ※ 1 |
酵素標識または蛍光標識アビジン(またはストレプトアビジン)が必要である。 |
| ※ 2 |
蛍光タンパク質は、測定対象波長域のフィルターへの蛍光の漏れ込みが起こりやすい為、多重染色を行う場合には蛍光色素の使用をお勧めする。 |
| ※ 3 |
蛍光タンパク質類は、蛍光色素に比べて蛍光強度が強く、蛍光波長が広いことからフローサイトメトリーで多く使用されている。 フローサイトメトリーで多重染色を行う場合、装置の蛍光漏れ込み補正(コンペンセーション)を実施することで、蛍光タンパ ク質の蛍光の漏れ込みを改善できる。 |
IV. どこを標識するのか
1.抗体の基本構造
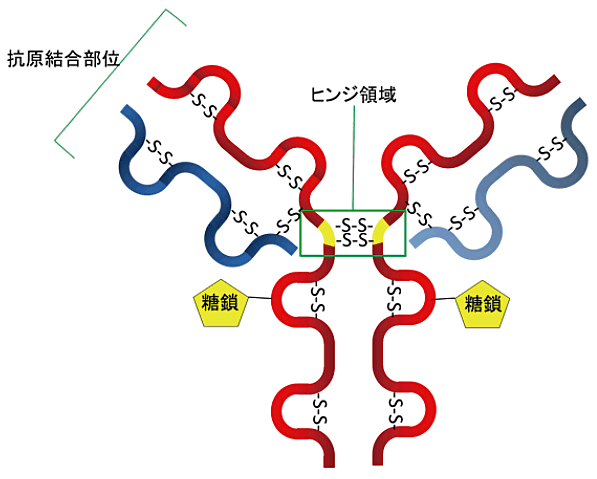
IgG 抗体は同数のH 鎖(50kDa:赤) とL 鎖(20 ~25 kDa:青) がそれぞれ2 本ずつジスルフィド結合(S-S 結合) しており、Y 字型の対称構造を呈している。
2. 標識対象の官能基
アミノ基(-NH2)は一般的なタンパク質や抗体には数多く存在するので、標識に利用しやすい。ただし、アスパラギンやグルタミン、アルギニンの側鎖のアミノ基は、アミド基、グアニジル基の一部で反応性が低く、標識の対象とはならない。
抗体のアミノ基の中で反応性が高いのは、リシン残基の側鎖アミノ基とタンパク質N 末端アミノ基であり、この部分が標識の対象となる(図3)。
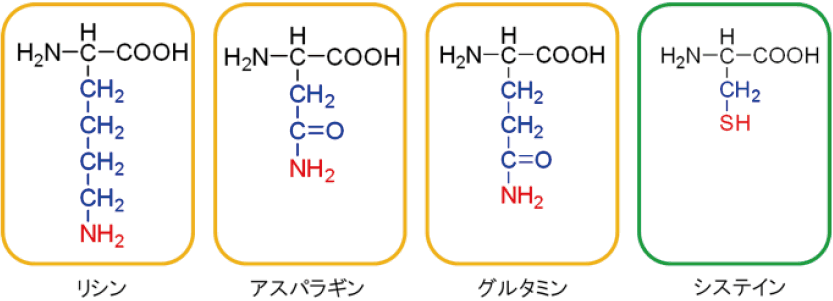
一方、スルフヒドリル基(-SH)はシステイン残基の側鎖の一部である。ただし、抗体中のシステイン残基はジスルフィド結合(-S-S-)を形成し、高次構造を保つのに利用されているので、そのまま標識に利用することは難しい。そのために、還元剤を用いてジスルフィド結合を還元し、SH 基として標識に使用する。ただし、抗体やタンパク質中のすべてのジスルフィド結合を還元すると、タンパク質の機能が失われる可能性があるので、一部のジスルフィド結合のみを還元し、機能を保持したまま標識部位として利用する。
この他にも、抗体の糖鎖を酸化してアルデヒド基(-CHO)を生成し、シッフ塩基結合によって標識に利用する方法もある。
V. どのようにして標識するのか
1. 抗体への低分子(蛍光色素、ビオチンなど)の標識方法
前述の通り、抗体への標識にはアミノ基(-NH2)が利用されることが多い。例えば、ビオチンを標識する場合は、ビオチン分子にアミノ基と反応する活性エステルを導入した化合物を使用する。アミノ基反応性活性エステルとしては、一般にN- ヒドロキシスクシンイミド活性エステル(NHS エステル)が用いられる。NHS エステルは、一級アミンとpH8付近で効率よく反応し、安定なアミド結合を形成する。pH7 付近では、アミノ基がプロトン化している割合が高く(-NH3+の構造をとっている)、反応性が低い(求核性が弱い)。一方、pH9 以上では、アミノ基のプロトン化の割合は低くなるが、NHS エステル自身の加水分解が進みやすく、反応効率が低くなる。
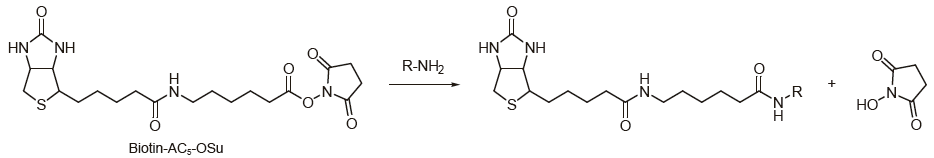
また、SH 基を標識に利用する場合は、マレイミド基を導入した低分子を使用する。マレイミド基は、抗体標識に適した以下の利点を有する2)。
1) 反応条件が温和で、かつ反応収率も高い。
2) 反応がSH 基選択的で、中性pH 付近ではアミノ基に比べ約1,000 倍速く反応する。
3) マレイミド基とSH 基の反応により形成された結合は安定である。
ただし、マレイミド基は加水分解されやすいので、必ず中性pH 付近で反応を行い、pH を上げることは極力避けた方がよい。SH 基とマレイミド基との反応はpH6 ~ 7 で十分に進行する。
2. 抗体へのタンパク質の標識方法 ~高分子標識の難しさ~
低分子である蛍光色素やビオチンの抗体への標識は、前述の活性エステルを導入した試薬を用いれば、比較的容易に行える。しかし、酵素や蛍光タンパク質などの高分子を抗体に標識するのは、低分子標識とは異なった技術が要求される。特に、アミノ基を利用する方法は、標識する酵素や蛍光タンパク質の活性を保つ温和な条件で反応させる必要がある。さらに、抗体と同様に、酵素や蛍光タンパク質にもアミノ基が多数存在するので、酵素や蛍光タンパク質自身が重合するのを避けなければならない。そのために、後に述べる1) 過ヨウ素酸法や2) グルタルアルデヒド法は、抗体標識の経験がない研究者にとっては、実施しにくい方法である。これを改善するために、標識したい酵素や蛍光タンパク質が持つアミノ基と二価性試薬を反応させてマレイミド基を導入し、抗体のジスルフィド結合を還元して得られるSH 基と反応させる3) マレイミド法が有効とされている。
小社では、抗体と混合するだけで酵素や蛍光タンパク質の標識抗体を得ることができる技術、4)NHS 法を開発し、キット化することに成功した。本方法は、酵素や蛍光タンパク質にアミノ基反応性の官能基を組み込んでおり、簡便に目的の抗体(タンパク質)に酵素や蛍光タンパク質を標識することが可能である。本手法が、抗体(タンパク質)を直接標識したい研究者のお役に立てれば幸いである。
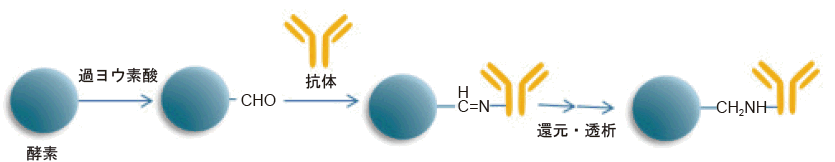
1) 過ヨウ素酸法
酵素の糖鎖部分を過ヨウ素酸で酸化し、アルデヒド基を導入する。酵素のアルデヒド基と抗体のアミノ基が反応して、シッフ塩基(CH=N)が形成される。このシッフ塩基は不安定な為、C=N 二重結合を還元する必要がある。しかし、還元剤処理は酵素や抗体の活性を低下させる可能性が高く、ペルオキシダーゼ(HRP)のような比較的化学修飾に強い酵素以外には、本手法の適応は難しい2)。
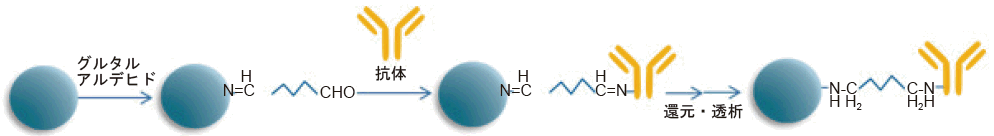
2) グルタルアルデヒド法
酵素を過剰のグルタルアルデヒドで処理し、酵素にアルデヒド基を導入する。それ以後は、過ヨウ素酸法と同様に抗体のアミノ基と反応させ、還元剤で処理する。グルタルアルデヒドはタンパク質架橋剤、アミノ基修飾剤であるので、過剰のグルタルアルデヒド処理は、酵素の活性低下が起こる可能性が高く、注意が必要である。
3) マレイミド法
SH 基選択的な反応基としてマレイミドを有する架橋剤を用いる方法で、温和(中性pH 域)な条件で選択的な架橋ができる。生成する結合の安定性も高く、優れた標識法である。まず、架橋剤と酵素のアミノ基を反応させて、マレイミド基を導入する。抗体は予め還元剤で処理し、抗体中のジスルフィド結合(-S-S-)を解裂してSH 基を形成させたものを使用する。ただし、還元剤は抗体のヒンジ部のジスルフィド結合のみを特異的に還元する訳ではなく、実際は抗体の様々な部分のジスルフィド結合を還元する。マレイミド導入酵素と還元処理抗体とを反応させ、標識体を得る。本手法は、後に紹介するSH 基への標識キット原理に応用されている。
また、IgG をペプシンで消化すると、Fc 部分が消化されてF(ab')2 が得られる。F(ab')2 は還元すると2 つのFab' に切り離される。Fab' は抗原結合部位の反対側のヒンジ部にSH 基を持っているので、Fab' にマレイミド法で標識することが可能である( 図17 参照)。Fab' を用いると抗体の活性を失うことなく、しかも非特異的吸着の少ない酵素標識Fab'を得ることができるという利点がある。一方、IgG をパパインで消化すると、ヒンジ部分も消化されてSH 基を持たないFab が得られる。Fab はSH 基がなく、マレイミド法で標識されないので、アミノ基を使った標識を行う必要がある。

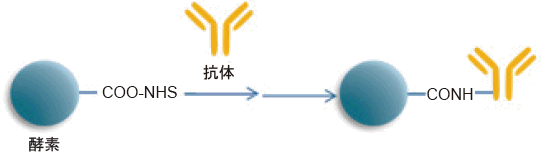
4) NHS(N- ヒドロキシスクシンイミド)法
NHS によって酵素のカルボキシル基を選択的に活性化する方法である。小社では、酵素自身のアミノ基をキャッピングすることにより酵素自身の重合を防ぎ、安定なアミノ基反応性活性体を得ることに成功した。さらに、反応条件を最適化することにより、酵素の劣化を最小限に抑えている。NHS で活性化した酵素と抗体を反応する方法では、酵素と抗体は安定なアミド基で結合しているので、還元の必要はなく、比較的不安定なALP( アルカリホスファターゼ) にも適用が可能である。また、IgG 以外のタンパク質の多くはジスルフィド結合(-S-S-)によって高次構造を保っているので、還元剤の使用はタンパク質自体の機能を失う危険性を伴う。このような場合は、還元剤を使用せずに標識できるNHS 法を用いることにより、タンパク質を失活させることなく、標識体を得ることができる本手法は有効である。本手法は、後に紹介するアミノ基への標識キット原理に応用されている。