PAN
比色試薬/金属指示薬
-
製品コードP002 PAN
-
CAS番号85-85-8
-
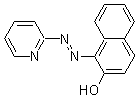
化学名1-(2-Pyridylazo)-2-naphthol
-
分子式・分子量C15H11N3O=249.27
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 1 g | ¥9,400 | 344-02131 |
性質
PANは多くの金属と有色錯体を形成し、有機溶媒に抽出されることより、金属の抽出比色試薬として用いられる。また、変色を利用してキレートの指示薬としても用いられる。
PANは橙赤色結晶性粉末で、140 ℃付近に融点をもつ。水にはほとんど溶けない。強酸性でわずかに溶け、アルカリ性にすれば水に溶解する。酸解離定数はpKa1=2.9, pKa2=11.6(μ=0.1 NaClO4, 室温)である。水溶液はpH12程度までは黄色、それ以上の強アルカリ性では赤色となる。
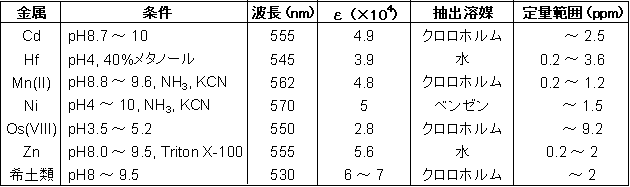
PANは極めて安定で、有機溶媒にとかしても長期間保存できる。クロロホルム-水、四塩化炭素-水系の分配係数はそれぞれ、logKD(CHCl3/H2O)=5.4, logKD(CCl4/H2O)=4.0である。PANの精製はメタノールからの再結晶法と昇華法が知られている。純度の確認はシリカゲルTLCで行う。石油エーテル(10):エーテル(10):エタノール(1)の混合溶媒で展開すれば、Rf=0.68にスポットを与える。各種金属との安定度定数、および比色定量条件を各々、表1及び表2に示す。
応用可能な金属
キレート滴定指示薬として:
Bi, Cd, Ce, Cu, Ga, In, Tl, UO22+, Zn
抽出比色試薬として:
Ag, Bi, Cd, Co, Cr, Cu, Fe, Ga, Hf, Hg, In, Ir, Mn, Nb, Ni,Os, Pd, Pt, Rh, Ru, Sb, Ti, Tl, UO22+,VO2+, Zn, Zr, 希土類
技術情報
表1 金属-PANキレート生成定数 (25℃)
表2 PANを用いる主な金属の比色定量条件
図. PANを指示薬とする滴定の変色例
*注:ご覧になるモニターにより、実際の色合いとは異なる場合がございます。
あくまで目安としてご覧下さい。
溶解例
25 mg/100 mL(メチルアルコール)
参考文献
1) S. Shibata, "Solvent Extraction Behavior of Some Metal-1-(2-Pyridylazo)-2-naphthol Chelates", Anal. Chim. Acta, 1960, 23, 367.
2) 柴田正三, "1-(2-ピリジルアゾ)-2-ナフトール(PAN)とその類縁体", Jpn. Anal., 1972, 21, 551.
3) 柴田正三, 古川正道, "モル吸光係数・105台の金属錯体を生成する呈色試薬の開発", Jpn. Anal., 1974, 23, 1412.
よくある質問
-
Q
Cuの直接滴定
-
A
下記方法を参考にして下さい。
<試薬>
・0.01M EDTA標準液
・PAN指示薬溶液
・緩衝液 酢酸-酢酸ナトリウム混液(pH2.5~6)
・メタノール<操作>
・試料溶液(Cu 30 mg以下)は約75 mLに希釈し、緩衝液を加えてpHを2.5~6に調整する。
次にメタノール25 mL,PAN指示薬溶液数滴を加え、0.01M EDTA標準液で滴定する。
終点の変色は 赤→黄。 Cu含量の多い場合には 赤→青緑。0.01 M EDTA 1 mL = 0.6355 mg Cu
<備考>
・Cu-PANキレート化合物は水に難溶なコロイド状沈殿を生成するため終点付近でEDTAとの
反応速度が遅い。したがって熱時滴定するか、上記操作のようにCu-PANの溶解度を増すため
25~50%有機溶媒を添加する必要がある。有機溶媒としてはメタノールのほか、エタノール,
イソプロパノール,ジオキサン,ジメチルホルムアミドなど水と混合しうる溶媒がメタノールと
同様にもちいることができる。また、グリセリン,エチレングリコールのように沸点の高い溶媒を
添加して、熱時滴定すれば、加熱効果と溶媒効果を同時にあげることができ、
終点が明瞭になるといわれている。Cu-PANをもちいる直接滴定においても同様の効果が得られる。・Cu2+はpH2.5~10の範囲で滴定することができるが、低いpHで滴定するほど共存イオンの影響は
少なくなる。たとえばpH4~5で滴定すればアルカリ土類金属イオンおよび少量のMn2+は影響せず、
またpH2.5~3で滴定すれば、そのほか少量のZn,Cdが共存しても影響しない。
pH7以上ではアンモニア-塩化アンモニウム系緩衝液をもちいるが、このpHではアルカリ土類金属を
はじめ多くの多価金属イオンが存在する場合は一部ないし全部滴定にかかってくる。・酸性領域(pH4~5)ではZn2+,Cd2+,Pb2+,Hg2+などは一緒に滴定されるが、Cu2+はチオ硫酸ナトリウム,
チオ尿素などによって選択的にマスクされるので、PANを指示薬として上記操作によって滴定して
これら金属イオンの合計を求め、次にCu2+をマスクした後、適当な指示薬をもちいてCu2+以外の
金属イオンの量をもとめ、二つの滴定値の差からCu2+の量を算出することが出来る。
あるいは次のような方法もとることが出来る。
§Cu2+を含む試料溶液に酢酸塩緩衝液(ヘキサミンはCu2+の場合よくない)を加えpH4~5にする。
§10%Na2S2O3(チオ硫酸ナトリウム)溶液を溶液が無色になるまで加えCu2+をマスクしたのち
Pb,Hg,Zn,Cdなどを滴定する。もしこれ以上過剰に加えると、Zn,CdなどもNa2S2O3と反応し、
終点における指示薬の変色が不明瞭になる。指示薬はNa2S2O3を添加した後で加える方がよい。
通常Cu2+15mgをマスクするのに10%Na2S2O34~5mLで十分である。
§滴定を終わった溶液に30%H2O2数滴を加えればCu2+がデマスクされるので、ひきつづき滴定し
Cuを定量する。・PAN指示薬による滴定にならって、PARを指示薬とすれば、常温で直接滴定できる。
またTARを指示薬とすれば、pH4~6の領域で常温にて滴定できる。
終点の変色は 赤紫→黄 で、Cu2+に対する指示薬のうちで最も変色が鋭敏である。・酢酸塩緩衝液をもちいpH4~6にて、XOまたはMTBを指示薬とし70℃以上に加熱滴定する事ができる。
加熱はブロッキングを避けるためで、ごく少量のオルトフェナントロリンえお添加するか、
緩衝剤にMESを用いれば、常温で滴定することもできる。また、逆滴定でCu2+を定量するときには
Cu2+のブロッキングはおこらないので、Pb(またはZn)標準液-XO指示薬の組み合わせがよくもちいられる。*「キレート滴定」上野景平著(南江堂出版)より
-
Q
Moの滴定方法(Cuによる逆滴定)
-
A
下記方法を参考にして下さい。
<試薬>
・0.05 M EDTA標準液
・0.05 M CuSO4標準液
・PAN指示薬溶液
・アンモニア水, H2SO4(1:1)
・95%エタノール
・硫酸ヒドラジン(固形)
・酒石酸(固形)<操作>
①Moとして5~30 mgを含むほとんど中性の試料溶液に、Moに対して過剰のEDTA標準液の
一定量を加え、次に酒石酸5 g,硫酸ヒドラジン2~5 g,H2SO4(1:1)2 mLを順次添加したのち
5分間加熱沸騰させる。
②この溶液にアンモニア水を注意して滴下しpH4.5~5に調製したのち、1/3容のエタノールと
PAN指示薬溶液数滴を加え、ほとんど沸騰するまで加熱しながらCu標準液で滴定する。
③終点の変色は 黄色→赤紫
最初に加えたEDTA標準液および逆滴定に消費したCu標準液をそれぞれA mL、B mLとすればMo=(A-B)x 9.594 mg
<備考>
・Mo5+とEDTAの結合比は2:1であるため、0.05 M EDTA標準液の当量は
0.05 M EDTA 1 mL = 2x(5/100)x95.94=9.594 mg
となる。・Mo(Ⅴ)-EDTAキレート化合物は黄色を呈するため、Mo濃度が高いと終点の変色が不明瞭になる。
この場合は紫外線照射下カルセインを指示薬とすればよい。終点で蛍光が消える。・終点はふりこ滴定によれば、さらに正確に定めることができる。すなわちEDTA標準液とCu標準液を
入れた2本のビュレットを準備して上記の操作を行い、終点に達したら両標準液を交互に滴下して
終点の変色を繰り返し、正確な終点をはさみ打ちによって定める。
この際、両標準液の総消費量がそれぞれA mL,B mLになる。このふりこ滴定は一般に終点の変色の
にぶい滴定の場合に応用すれば、普通の滴定法より高い精度を得ることが出来る。・XO指示薬をもちいPb標準液で逆滴定すれば終点はなお明瞭である。ヘキサミンを加え
pH5±0.2とし室温で滴定する。・Mo(Ⅵ)は硫酸ヒドラジンと加熱することによりMo(Ⅴ)に還元されるが、Wが共存すると
還元が不完全になり、正確な滴定値が得られない。しかし酒石酸を加えてWをマスクすれば
400倍量のWが共存しても±1%の誤差でMoを定量することが出来る。・この条件では多くの多価金属イオンは一緒に滴定されるが、Cu2+はチオ尿素でマスクされ、
Ti4+,Ta5+,Nb5+はW5+と同様に酒石酸でマスクされ、Th4+,Al3+,Ce3+,U4+はNH4Fでマスクされる。
Fe3+は妨害するが、Alとともに水酸化物として分離することができる。
ほとんどすべての陰イオンは妨害しない。・0.5~5 mgのMoに対しては0.05 M標準液をもちいて、前述の操作とまったく同じ条件で±0.5%以内の
誤差で滴定することができる。
*「キレート滴定」上野景平著(南江堂出版)より
-
Q
Tiの逆滴定
-
A
この方法は逆滴定になります。下記方法を参考にして下さい。
<試薬>
・0.01mol/L EDTA標準液
・0.01mol/L CuSO4標準液
・PAN指示薬溶液
・50% NaOH溶液
・30% H2O2溶液<操作>
①Tiを含む試料を硫酸白煙まで加熱したのち、室温まで冷却し氷(蒸留水から作ったもの)
10~15 gとH2O2溶液3滴を加える。
Tiの量が多い時は、この溶液をメスフラスコに移し、水で標準まで希釈し、その一部をとる。
②Tiとして約10 mgを含む溶液をとり、EDTA標準液の一定過剰を加え約100 mLに希釈したのち
NaOH溶液を滴下してpH4~5に調整する。
③PAN指示薬数滴を加え、Cu標準液で逆滴定する。
④終点の変色は 橙黄色→橙赤色
はじめに加えたEDTA標準液および逆滴定に消費したCu標準液の量をそれぞれA mL,B mLとするとTi=(A-B)x 0.4790 mg
<備考>
・Tiは空気中ではTi(IV)が安定で、水溶液中ではTiO2+として存在する。TiO2+はH2O2の存在下では
[TiO(H2O2)Y]2-の非常に安定なキレートを生成する。しかし、H2O2がないとキレートは不安定で
滴定でよい結果が得られない。・Ti,Fe,Alの混合試料ではTiのみを滴定出来ない。Tiを酒石酸でマスクすれば、上記の方法で
Fe+Alが測定できるので、差し引きでTiが求められる。・Tiの濃度が高くなると黄色が濃くなって指示薬の変色が見にくくなるが、蛍光金属指示薬を
もちいればその障害を避けることができる。
たとえば、カルセインブルー,アニシジンブルーなどである。
また、EDTAよりCyDTAをもちいるほうが終点はより明瞭である。
*「キレート滴定」上野景平著(南江堂出版)より
-
Q
指示薬調整法
-
A
PANを0.1~0.01%濃度になうようにアルコールに溶かして、ご使用ください。(メタノールやエタノール)
取扱条件
| 性状: | 本品は、黄橙色~赤橙色粉末または結晶性粉末でありメチルアルコールに溶ける。 |
|---|---|
| メチルアルコール溶状: | 試験適合 |
| 吸光度: | 0.600 以上(470 nm付近) |
| 融点: | 138~145℃ |
| 強熱残分(硫酸塩): | 1.0% 以下 |
| 鋭敏度: | 試験適合 |
| IRスペクトル: | 試験適合 |