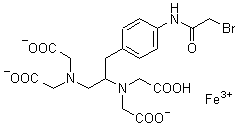
FeBABE
生体高分子機能解析用試薬
-
製品コードF279 FeBABE
-
CAS番号186136-50-5
-
化学名1-(p-Bromoacetamidobenzyl)ethylenediamine-N,N,N',N'-tetraacetic acid, iron(III)
-
分子式・分子量C19H21BrFeN3O9=571.13
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 1 mg | ¥19,600 | 345-08641 |
性質
EDTAはFeイオンと結合すると、還元条件下でラジカルを発生し生体高分子を切断する性質をもっている。DNA結合タンパク質のDNA上の結合部位を、FeEDTAによる切断抵抗性領域として同定する「DNAフットプリンティング法」、タンパク質複合体中で表面に露出した部分を切断感受性領域として調べる「プロテインフットプリンティング法」は、生命科学では広く利用されている。FeEDTAのこの反応性を利用し、タンパク質の特定部位にFeEDTAを結合し、その周辺の接触する核酸やタンパク質を同定し、また接触点を同定する目的で、BABEが生命科学研究に広く利用されるようになってきた。
BABEは、当初、金属を生体物質に結合させる架橋試薬として開発され、EDTA部分に放射性111In3+を結合させ、抗腫瘍性抗生物質であるブレオマイシンA2の末端に結合し、その集積でマウスの腫瘍部位を同定するなどの、薬理学的・臨床的な利用が計られてきた1)。Feイオンを結合したBABE (FeBABE)がタンパク質のペプチド結合と核酸ホスホジエステル結合の両方を選択的に、しかしアミノ酸配列・ヌクレオチド配列に関係なく、非特異的に切断する活性が注目され2, 3)、その有用性が認められたことで効率的合成法が開発された4)。
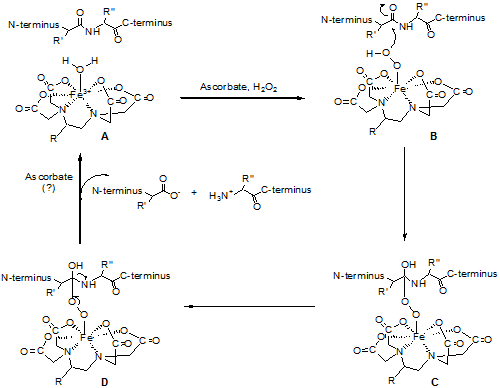
タンパク質結合性のEDTA化合物は一般にMeares試薬と呼ばれる。BABEはbromoacetamido基によって、タンパク質のシステイン残基のSH基と温和な条件で反応する。タンパク質の天然のシステイン残基あるいは遺伝子工学的手法によって導入したシステイン残基にFeBABEを結合し、アスコルビン酸と過酸化水素を加えると活性ラジカルが発生し、ラジカル飛程距離内の核酸やタンパク質の主鎖の切断が起きる。この切断反応は秒単位で進行するので、反応は10秒から10分程度の短時間で良い。FeBABEの分子構造から推定して、タンパク質システイン残基から1.2 nmの位置にFeイオンが配置されるので、開裂するのはその周辺に限られる。切断個所をヌクレオチド配列やアミノ酸配列から解析することで、接触していた相手物質とその分子上の接触点を同定することが出来る。従って、タンパク質非結合型の切断試薬では得られない、タンパク質の三次元構造に関する情報までも得ることができる。核酸の切断に関してはヒドロキシルラジカルを介した酸化的な反応によるものと考えられているが5)、ペプチド結合切断の機構としてはそれ以上に、鉄に配位したペルオキソ中間体によるカルボニル炭素の求核攻撃説が提唱されている3)。
FeBABEの利点としては、1)ペプチドやタンパク質へ温和な条件で結合できること、2)温和な条件で開裂反応を行えること、3)開裂反応が速く、高収率であること、4)核酸やタンパク質の主鎖が選択的に切断されるが、ヌクレオチドやアミノ酸配列に影響されないこと、などが挙げられる。また、タンパク質のリジン残基や末端アミノ基に、2-iminothiolane (2-IT)を介在させることで、FeBABEを結合する応用法が開発された6)ことによって、FeBABEの利用範囲はさらに拡大した。
FeBABEをタンパク質-タンパク質間相互作用の接点解析に利用した例としては、大腸菌チトクロームbdオキシダーゼのサブユニットIとIIの接点の同定7)、大腸菌RNAポリメラーゼのα,β,β',σサブユニット間の接点の同定8,9)などがある。一方、核酸切断からタンパク質の結合領域を同定した研究としては、大腸菌RNAポリメラーゼの遺伝子プロモーター結合域の同定10,11)や、リボゾームタンパク質のrRNA結合点の同定12-14)などがある。
このように高分解能の構造情報が得られない複雑なタンパク質集合体のサブユニット内、あるいはサブユニット間、さらにそれらと相互作用する核酸分子との空間的関係を解明するのに有効であり、今後広く利用されると期待される。
FeBABEによるペプチド結合の切断機構3)
技術情報
溶解例
緩衝溶液、DMSOに可溶
参考文献
1) L. H. DeRiemer, C. F. Meares, D. A. Goodwin and C. I. Diamanti, "BLEDTA II: Synthesis of a New Tumer-Visualizing Derivative of Co(III)-bleomycin", J. Labelled Compd. Radiopharm., 1981, 18, 1517.
2) T. M. Rana and C. F. Meares, "Specific Cleavage of a Protein by an Attached Iron Chelate", J. Am. Chem. Soc., 1990, 112, 2457.
3) T. M. Rana and C. F. Meares, "Transfer of Oxigen from an artificial protease to peptide carbon during proteolysis", Proc. Natl. Acad. Sci. USA, 1991, 88, 10578.
4) D. P. Greiner, R. Miyake, J. K. Moran, A. D. Jones, T. Negishi, A. Ishihama and C. F. Meares, "Synthesis of the Protein Cutting Reagent Iron (S)-1-(p-Bromoacetamidobenzyl)ethylebediaminetetraacetate and Conjuation to cysteine Sie Cahins", Bioconjugate Chem., 1997, 8, 44.
5) E. Platis, M. R. Ermacora and R. O. Fox, "Oxidative Polypeptide Cleavage Mediated by EDTA-Fe Covalently Linked to Cysteine Residue", Biochemistry, 1993, 32, 12761.
6) S. L. Traviglia, S. A. Datwyler, D. Yan, A. Ishihama and C. F. Meares, "Targeted Protein Footprinting: Where Different Transcription Factors bind to RNA Polymerase", Biochemistry, 1999, 38, 4259.
7) J. B. Ghaim, D. P. Greiner, C. F. Meares and R. B. Gennis, "Proximity Mapping the suface of Membrane Protein Using an Artificial Protease: Demonstration That the Quinone-Binding Domain of Subunit I Is near the N-Terminal Region of Subunit II of Cytochrome bd", Biochemistry, 1995, 34, 11311.
8) R. Miyake, K. Murakami, J. T. Owens, D. P. Greiner, O. N. Ozoline, A. Ishihama and C. F. Meares, "Dimeric Association of Escherichia coli RNA Polymerase alfa subunits, studied by Cleavage of Single-Cysteine alfa Sununits Conjugated to Iron-(S)-1-(p-(Bromoacetamido)benzyl)ethylenediaminetetraacetate", Biochemistry, 1998, 37, 1344.
9) J. T. Owens, R. Miyake, K. Murakami, A. J. Chmura, N. Fujita, A. Ishihama and C. F. Meares, "Mapping the sigma70 subunits contact sites on Escherichia coli RNA polymerase with a sigma70-conjugated chemical protease", Proc. Natl. Acad. Sci. USA, 1998, 95, 6021.
10) J. A. Bown, J. T. Owens, C. F. Meares, N. Fujita, A. Ishihama, S. J. Busby and S. D. Minchin, "Organization of open complexes at Escherichia coli promoters. Location of promoter DNA sites close to region 2.5 of the sigma70 subunit of RNA polymerase", J. Biol. Chem., 1999, 274, 2263.
11) F. Colland, N. Fujita, D. Kotlarz, J. A. Bown, C. F. Meares, A. Ishihama and A. Kolb, "Positioning of sigma(S), the stationary phase sigma factor, in Escherichia coli RNA polymerase-promoter open complexes", EMBO J., 1999, 18, 4049.
12) G. M. Heilek, R. Marusak, C. F. Meares and H. F. Noller, "Directed hydroxyl radical probing of 16S rRNA using Fe(II) tethered to ribosomal protein S4", Proc. Natl. Acad. Sci. USA, 1995, 92, 1113.
13) G. M. Heilek and H. F. Noller, "Site-directed hydroxyl radical probing of the rRNA neighborhood of ribosomal protein S5", Science, 1996, 272, 1659.
14) K. R. Lieberman and H. F. Noller, "Ribosomal protein L15 as a probe of 50 S ribosomal subunit structure.", J. Mol. Biol., 1998, 284, 1367.