-Cellstain®- AO solution
核染色用色素
-
製品コードA430 -Cellstain®- AO solution
-
CAS番号65-61-2(AO)
-
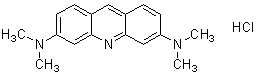
化学名3,6-Bis(dimethylamino)acridine, hydrochloride, solution
-
分子式・分子量C17H20ClN3=301.81
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 1 ml | ¥7,100 | 348-07911 |
性質
1 mg/mL H2O溶液
Acridine Orange (AO)は、dsDNA に結合して526 nmの緑色の蛍光(励起波長502 nm)を発し、ssDNAやRNAに結合して650 nmの赤色の蛍光(励起波長460 nm)を発する核酸染色色素である。
二本鎖構造の核酸に取り込まれる場合、まずリン酸と静電的に結合して二本鎖の中に3塩基対に対し1個の割合で取り込まれる。この時、挿入されたAOは互いに隣接することなく単量体で存在し、その結果AO本来の蛍光スペクトル(526 nm)を示す。単鎖構造の核酸に取り込まれる場合、リン酸基と最大1対1の割合で静電的に結合し、隣接するAO分子間でstackingやaggregationを起こす。その結果、単量体の場合と異なる蛍光(650 nm)を示すようになる。このようにAOのみで二本鎖、及び単鎖型DNAやRNAを分別染色することができ、Arレーザーで励起することによりDNAとRNAの同時観察が、また、フローサイトメトリーを用いて同時定量解析ができるという特徴がある。
本製品は変異原性があるため、使いきりタイプとして製品化した。秤量する時の実験室内への粉末の飛散を防ぎ使いやすくなっている。
蛍光特性:(dsDNA) λex= 500 nm, λem= 520 nm、
(ssDNA) λex= 420~460 nm, λem= 630~650 nm
参考文献
1) I. W. Taylor and B. K. Milthorpe, "An Evaluation of DNA Fluochromes, Staining Techniques, and Analysis for Flow Cytometry. I. Unperturebed Cellpopulations", J. Histochem. Cytochem., 1980, 28(11), 1224.
2) N. Miyoshi, K. Hara, I. Yokoyama, G. Tomita and M. Fukuda, "Fluorescence Lifetime of Acridine Orange in Sodiu Dodecyl Sulfate Premicellar Solutions", Photochem. Photobiol., 1988, 47(5), 685.
3) A. K. El-Naggar, J. G. Batsakis, K. Teague, L. Garnsey and B. Barlogie, "Single- and Double-stranded RNA Measurements by Flow Cytometry in Solid Neoplasms", Cytometry, 1991, 12, 330.
4) Y. Miyakoshi, H. Yohioka, Y. Toyama, Y. Suzuki and H. Shimizu, "The Frequencies of Micronuclei Induced by Cisplatin in Newborn Rat Astrocytes Are Increased by 50-Hz, 7.5- and 10-mT Electromagnetic Fields", Environ. Health and Prev.ive Med. 2005, 10(3), 138.
よくある質問
-
Q
核染色剤に使用される色素の特徴、違いは何でしょうか?
-
A
ここで紹介している色素は核酸との相互作用により蛍光を発するか、蛍光強度が強くなる特徴があります。
蛍光波長以外の違いとしては下記の点がございます。
【EB】
塩基特異性は無く、全DNA,RNAに結合します。
生細胞の膜透過性がなく、死細胞を染色します。【PI】
EBと同様に塩基特異性はありません。インターカレーションした時の蛍光強度が
EBより高いため、より広く使用される色素です。
生細胞の膜透過性がなく、死細胞を染色します。【DAPI】
2重鎖の副溝(minor groove)と結合します。アデニン-チミジンクラスターに高い結合性を持っています。
生細胞の膜透過性がなく、死細胞を染色します。【AO】
2重鎖にインターカレーションしたときと、単鎖のリン酸に結合した時では蛍光波長が異なることを
利用して、2重鎖と単鎖を区別して検出できます。
生細胞の細胞膜を透過します。【Hoechst33342、33258】
DNAのアデニン-チミジン部に特異的に結合します。
生細胞の細胞膜を透過し、生細胞のDNAを染色できる色素です。
-
Q
細胞染色色素の励起と蛍光の波長を教えて下さい
-
A
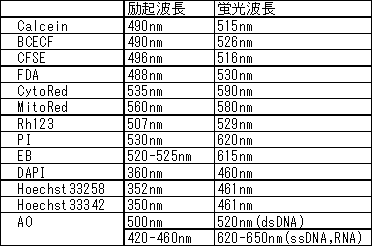
*AOはフローサイトメトリーなどでは488 nm励起で観察されることもあります
-
Q
AOの使用方法を教えて下さい。
-
A
下記に一例を示します。
*細胞の種類、観察条件により濃度や固定の検討が必要です。○HeLa細胞を用いた細胞染色
①AO 1 mgを純水 1 mLに溶解し、ストック溶液とする。
②ストック溶液10 μLをPBS緩衝液5 mLで希釈する。(AOは約6 μmol/Lとなる)
③HeLa細胞をトリプシン-EDTAなどで回収し、細胞の懸濁液を準備する。
④この細胞懸濁液を遠心分離する。(1000 rpm, 3 min)
上清を除き、PBSを添加し、ピペッティングで十分分散させる。
(この時、細胞数が105~106 cells/mLになるように調整する)
⑤1.5 mlマイクロチューブに④で得た細胞懸濁液30 μLを添加する。
⑥これに②のAO溶液15 μLを添加し、37℃で15分インキュベートする。
⑦カバーガラス上に⑥の溶液10 μLをのせ、上からもう1枚カバーガラスを重ねる。
⑧このカバーガラスを蛍光顕微鏡に置き観察する。
蛍光特性:λex=502 nm, λem=526 nm(dsDNA)、λex=460 nm, λem=650 nm(ssDNA)○未固定細胞のDNA-RNAの同時染色の例
・Z.Darynkiewicz, Methods Cell Biol.,33,285(1990)より
①Detergent溶液を調整する。保存は4℃以下で行なう。
Triton X-100(100 μL), 1.0 mol/L HCl(8 mL), NaCl(877 mg)を純水に溶解し100 mLとする。
最終濃度はそれぞれ0.1%, 0.08 mol/L, 150 mmol/L となる。②色素溶液を調整する。保存は4℃以下で行なう。
1)100 mmol/Lクエン酸(37 mL)と200 mmol/L Na2HPO4(63 mL)を混和し、100 mLの溶液を作成する。
2)NaCl(877 mg)を加えて溶解する。
3)EDTA・2Na(34 mg)を加えて溶解する。
4)AO stock solution(1 mg/mL in H2O)600 μLを加える。
*最終濃度は、AO:20 μmol/L, EDTA・2Na:1 mmol/L, NaCl:150 mmol/L③検体溶液(2x105 cells/mL以下)200 μLにdetergent溶液400 μLを加え、
氷浴中に15秒静置する。不要な細胞の分解を防ぐ為に、検体倍地中に
血清を10~20%(v/v)含む方が望ましい。④氷水で冷却した色素溶液1.2mLを加え、その後3~15分の間に測定を行なう。
⑤フローサイトメトリーで測定する。
励起波長は488 nmを使用。蛍光フィルターとして520-580 nm(dsDNA), 620 nm(RNA,ssDNA)
などのバンドパスフィルターを使用する。
蛍光特性:λex=502 nm, λem=526 nm(dsDNA)、λex=460 nm, λem=650 nm(ssDNA)












