はじめに
細胞はさまざまな栄養素を取り込み、細胞内代謝を介してエネルギーを産生しています。このような栄養代謝は細胞外環境や細胞の状態、細胞の種類などによって異なっており、近年このような栄養代謝が単なるエネルギー産生だけでなく、遺伝子発現を含むさまざまな細胞機能制御にも関与していることが明らかとなっています。
グルコースは、主要な栄養素の一つであり、グルコースの取り込みや代謝を理解することは細胞機能を解明する上で非常に重要となります。本キットに含まれる蛍光標識グルコース誘導体 Glucose Uptake Probe-Greenはグルコーストランスポーターを介して細胞内に取り込まれるため、プレートリーダーで蛍光測定をすることで細胞のグルコース取り込み能力を測定することが可能です。本キットには、細胞内に取り込まれなかったGlucose Uptake Probe-Greenの蛍光を消去するQuenching Bufferが組み込まれているため、測定の際に細胞の洗浄を行う必要がなく、簡便にプレートリーダーで測定することができます。
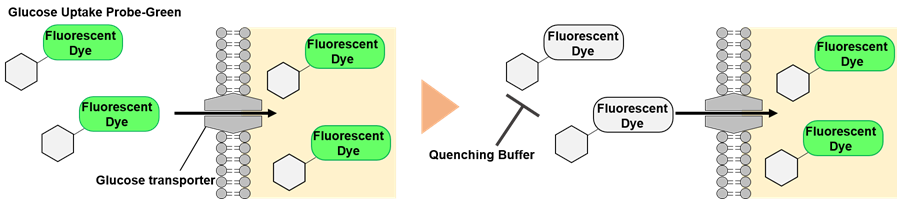
図1 Glucose Uptake Plate Assay Kitの測定原理
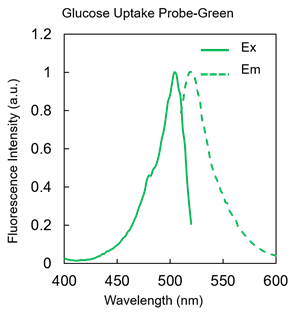
図2 Glucose Uptake Probe-Greenの蛍光特性
キット内容
| 100 tests | 500 tests | |
| Glucose Uptake Probe-Green | × 1 | × 5 |
| Quenching Buffer | 11 ml × 1 | 11 ml × 5 |
保存条件
0–5℃で保存してください。
必要なもの (キット以外)
- 20–200 µlのマルチチャンネルピペット
- 100–1000 µl、20–200 µl、2–20 µl マイクロピペット
- Dimethyl sulfoxide (DMSO)
- グルコース不含無血清培地
- 1.5 mlマイクロチューブ
- 蛍光プレートリーダー
- 96穴黒色クリアボトムマイクロプレート
使用上の注意
- キットの中の試薬は、室温に戻してからご使用ください。
- 輸送中の振動等により、内容物がチューブ壁面やキャップ裏面に付着している場合がありますので、内容物を底面に落とした後に開封して下さい。
- 正確な測定値を得るため、1つの測定試料につき複数 (n=3 以上) のウェルをご使用下さい。
- グルコース不含無血清培地やProbe working solution、Quenching Bufferはインキュベーターや水浴等で予め37℃付近に温めてご使用ください。細胞のグルコース取り込み能力に影響を与える場合があります。
- 剥がれやすい細胞種を使用する場合は実験例3の方法を参考に実験条件をご検討ください。
溶液調製
1. Probe stock solutionの調製
Glucose Uptake Probe-GreenにDMSO 40 µlを加え、ボルテックス及びピペッティングで溶解する。
- 調製後は、遮光下-20℃で保存してください。調製後は1ヶ月安定です。
2. Probe working solutionの調製
Probe working solutionをグルコース不含無血清培地で500倍希釈する。
- 細胞種によってProbe working solutionの最適濃度が異なります。希釈域250–1000倍で最適濃度をご検討ください。
操作
- 細胞をマイクロプレートに播種し、インキュベーター(37℃、5%CO2存在下)で一晩培養する。
- 培地を除去し、37℃に加温したグルコース不含無血清培地にて2回洗浄する。
- 培地はあらかじめ37℃付近に加温してください。
- 細胞が剥がれる場合は、実験例3のようにPoly-D-Lysine(PDL)コートしたプレートでご検討ください。
- 37℃に加温したグルコース不含無血清培地を添加し、インキュベーター(37℃、5%CO2存在下)で15分間静置する。
- 培地はあらかじめ37℃付近に加温してください。
- 上清を除去した後、37℃に加温したProbe working solution を添加し、インキュベーター(37℃、5%CO2存在下)で15分間静置する。
- Probe working solutionはあらかじめ37℃付近に加温してください。
- 細胞種によって最適な染色時間が異なります。最適時間をご検討ください。(時間:15分から1時間程度)
- Probe working solution と同体積の37℃に加温したQuenching Bufferを添加する。
- Quenching Bufferはあらかじめ37℃付近に加温してください。
- プレートリーダー (ボトムリーディング、Ex/Em=488/520 nm) で蛍光測定する。
- 蛍光強度が低下していくためQuenching Buffer添加後10分以内に測定してください。
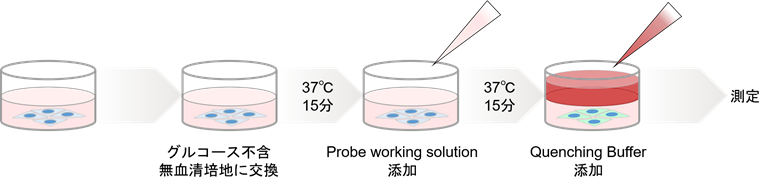
図3 キットの操作手順
- 詳細な実験手順については、「操作」の項をご確認ください。
実験例1
グルコース競合によるGlucose Uptake Probe-Greenの取り込み阻害(A549細胞)
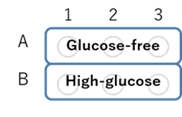
図4 プレートレイアウト例
- DMEM培地 (10% fetal bovine serum、1% penicillin-streptomycin) で調製したA549細胞懸濁液 (2.0 × 105 cells/ml, 200 µl/well) を96-well マイクロプレート (655090: greiner社) に播種し、インキュベーター(37℃、5%CO2存在下)で一晩培養した。
- 上清を除去した後、37℃に温めたDMEM (glucose-free、serum-free) 200 µlで2回洗浄した。
- 37℃に温めたDMEM (glucose-free、serum-free) 200 µlを各ウェルに添加し、インキュベーター(37℃、5%CO2存在下)で15分間静置した。
- 上清を除去した後、37℃に温めたDMEM (glucose-free、serum-free) またはDMEM (high-glucose、serum-free) を用いて調製したProbe working solution 100 µlを添加し (図4参照) 、インキュベーター(37℃、5%CO2存在下)で30分間静置した。
- 37℃に温めたQuenching Buffer 100 µlを添加した。
- プレートリーダー (機種 :TECAN社 Infinite M200 PRO、ボトムリーディング、Ex/Em=488/520 nm) 測定を行った。
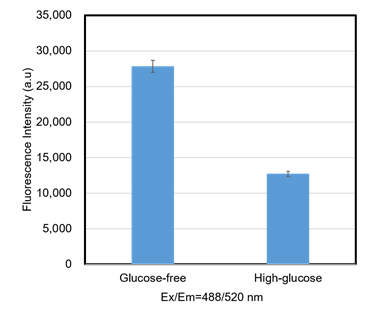
図5 グルコース競合によるGlucose Uptake Probe-Greenの取り込み阻害 (A549細胞)
A549細胞でグルコース競合によってProbeの取り込みが阻害され、蛍光強度が低下した。
実験例2
Cytochalasin BによるGlucose Uptake Probe-Green取り込み阻害(HepG2細胞)

図6 プレートレイアウト例
- DMEM培地 (10% fetal bovine serum、1% penicillin-streptomycin) で調製したHepG2細胞懸濁液 (2.0 × 105 cells/ml, 200 µl/well) を96-well マイクロプレート (ib89626 : ibidi社) に播種し、インキュベーター(37℃、5%CO2存在下)で一晩培養した。
- 0 µmol/l cytochalasin B または 7.5 µmol/l cytochalasin Bを含むDMEM培地 (10% fetal bovine serum、1% penicillin-streptomycin) を100 µl 添加し (終濃度2.5 µmol/l cytochalasin B) (図6参照) 、インキュベーター(37℃、5%CO2存在下)内で一晩培養した。
- 上清を除去した後、37℃に温めたDMEM (glucose-free、serum-free) 200 µlで2回洗浄した。
- 37℃に温めたDMEM (glucose-free、serum-free) 200 µlを各ウェルに添加し、インキュベーター(37℃、5%CO2存在下)で15分間静置した。
- 上清を除去した後、37℃に温めたDMEM (glucose-free、serum-free) を用いて調製したProbe working solution 100 µlを添加し、インキュベーター(37℃、5%CO2存在下)で15分間静置した。
- 37℃に温めたQuenching Buffer 100 µlを添加した。
- プレートリーダー (機種 :TECAN社 Infinite M200 PRO、ボトムリーディング、Ex/Em=488/520 nm) 測定を行った。
- 細胞数に応じたGlucose Uptake Probe-Green の蛍光強度を算出するため、Hoechst 33342 の蛍光強度を測定し、操作7で得られたGlucose Uptake Probe-Greenの蛍光強度を補正した。
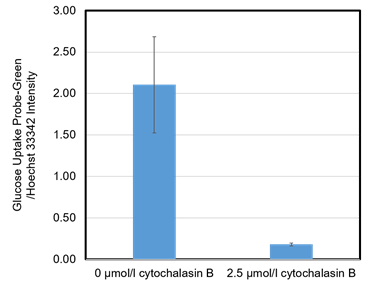
図7 Cytochalasin B によるGlucose Uptake Probe-Greenの取り込み阻害 (HepG2細胞)
Cytochalasin B処理によってHepG2細胞のグルコース取り込み能が低下した。
実験例3
2-Deoxy-D-glucoseによるGlucose Uptake Probe-Green取り込み阻害(HEK293細胞)

図8 プレートレイアウト例
- 1 mg/ml Poly-D-Lysine (PDL) をPBS(-)で10倍希釈した。
- 96-well マイクロプレート (655090: greiner社) の各ウェルに、希釈したPDL溶液を150 µlずつ添加し、室温で1時間静置した。
- PBS(-) 200 µlで3回洗浄した。
- MEM培地 (10% fetal bovine serum、1% penicillin-streptomycin) で調製したHEK293細胞懸濁液 (6.0 × 105 cells/ml, 200 µl/well) をPDLコートした96-well マイクロプレート に播種し、インキュベーター(37℃、5%CO2存在下)で一晩培養した。
- 900 mmol/l 2-Deoxy-D-glucose水溶液 (2-DG) 22 µlを添加し (終濃度 100 mmol/l 2-DG) (図8参照)、インキュベーター(37℃、5%CO2存在下)で2.5時間静置した。
- 上清を除去した後、37℃に温めたDMEM (glucose-free、serum-free) 200 µlで2回洗浄した。
- 37℃に温めたDMEM (glucose-free、serum-free) 200 µlを各ウェルに添加し、インキュベーター(37℃、5%CO2存在下)で15分間静置した。
- 上清を除去した後、37℃に温めたDMEM (glucose-free、serum-free) を用いて調製したProbe working solution 100 µlを添加し、インキュベーター(37℃、5%CO2存在下)で30分間静置した。
- 37℃に温めたQuenching Buffer 100 µlを添加した。
- プレートリーダー (機種 :TECAN社 Infinite M200 PRO、ボトムリーディング、Ex/Em=488/520 nm) 測定を行った。
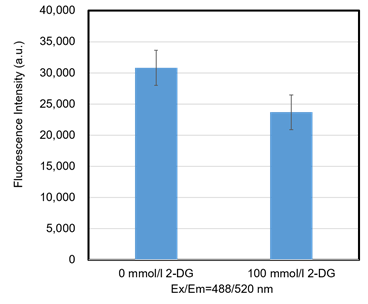
図9 2-DGによるGlucose Uptake Probe-Green取り込み阻害(HEK293細胞)
2-DG処理によってHEK293細胞のグルコース取り込み能が低下した。
UP08: Glucose Uptake Plate Assay Kit
Revised Aug., 27, 2025


 を押して省略できます。
を押して省略できます。