はじめに
大腸菌由来の β- ガラクトシダーゼ遺伝子 (lacZ) は、レポータージーンアッセイマーカーとして幅 広く用いられています。代表的な β- ガラクトシダーゼの検出方法として、X-gal 染色が広く利用され ていますが、細胞膜透過性が乏しいため、細胞や組織を固定化する必要があります。また、従来の β-galactosidase 検出蛍光試薬は細胞内滞留性が低いため、β-galactosidase 未発現細胞と発現細胞を明 瞭に区別できないことが課題でした。
これらの課題を克服するため、浦野、神谷らは細胞膜透過性と細胞内滞留性を有する新たな蛍光試薬 SPiDER-βGal の開発に成功しました 1)。本試薬は、β- ガラクトシダーゼとの酵素反応により、キノンメ チドと呼ばれる中間体を形成して、近傍のタンパク質中の SH 基等の求核性基と安定な共有結合を形成 し、蛍光性になります。このように、反応した試薬が細胞内タンパク質に固定化されることで優れた細 胞内滞留性を有し、その結果、β-galactosidase 発現細胞を一細胞レベルで明確に検出することが可能と なります。
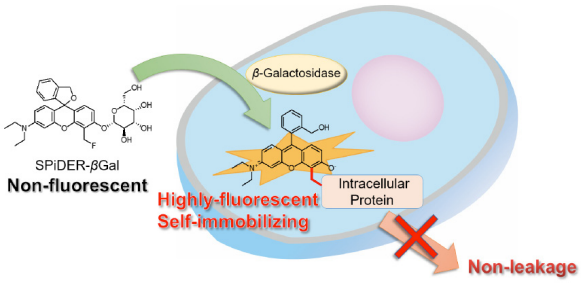
図1 SPiDER-βGal の細胞染色原理
- <推奨フィルター>
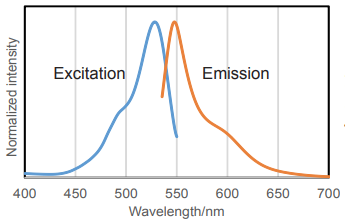
励起:500 ~ 540 nm
蛍光:530 ~ 570 nm
共焦点レーザー顕微鏡およびフローサイトメーターでは、488 nm 励起により検出した実績があります。
図2 β-galactosidase と反応後のSPiDER-βGal の励起・蛍光スペクトル
キット内容
| SPiDER-βGal 20 μg | x 3 |
保存条件
0-5℃にて保存してください。
- SPiDER-βGal は、アルミラミジップに 3 本入っています。未使用の SPiDER-βGal は、アルミラミジップに入れ たまま、チャックをしっかりと閉め、0-5℃で保存してください。
必要なもの (キット以外)
- Dimethyl sulfoxide (DMSO)
- Hanks’ HEPES buffer
- マイクロピペット
- マイクロチューブ
溶液調製
1 mmol/l SPiDER-βGal DMSO stock solution の調製
SPiDER-βGal 20 μg を含むチューブに 35 μl の DMSO を加え、ピペッティングにより溶解する。 溶解後の SPiDER-βGal DMSO stock solution は、-20℃以下で保存する。
1 μmol/l SPiDER-βGal working solution の調製
最終濃度が1 μmol/lになるように1 mmol/l SPiDER-βGal DMSO stock solutionをHanks’ HEPES buffer 等で希釈する。
- 細胞の状態を維持するため Hanks’ HEPES buffer の使用をお勧めします。
操作
SPiDER-βGal による細胞染色
- 細胞をディッシュまたはチャンバーに播種し、培養する。
- 培地を吸引除去後、Hanks’ HEPES buffer で 2 回洗浄する。
- 調製した SPiDER-βGal working solution を添加し、37℃で 15 分間インキュベートする。
- インキュベート後、蛍光顕微鏡やフローサイトメーターで観察する。
- 染色後、洗浄操作無しでも観察できますが、必要に応じて洗浄操作を行ってください。
実験例
蛍光イメージングでの β-galactosidase 発現細胞の検出
- 500 μl の HEK 細胞懸濁液 (5 x 105 cells/ml) と 500 μl の HEK/LacZ 細胞 (β-galactosidase 安定発現株 ) 懸濁液 (5 x 105 cells/ml) を 35 mm ディッシュに DMEM 培地 (10% fetal bovine serum、1% penicillin-streptomycin) で 播種し、5%CO2 インキュベーターで 37℃、一晩培養した。
- 培地を吸引除去後、2 ml の Hanks’ HEPES buffer で 2 回洗浄した。
- 調製した SPiDER-βGal working solution 2 ml を添加し、5%CO2 インキュベーター (37℃ ) で 15 分間インキュベートした。
- 上澄みを吸引除去し、2 ml の Hanks’ HEPES buffer で 2 回洗浄した。
- 2 ml の Hanks’ HEPES buffer を加え、蛍光顕微鏡で観察した。(図3 A)
- 上澄みを吸引除去し、4% パラホルムアルデヒド (PFA)/PBS 溶液 2 ml 加え、室温で 15 分間固定化した。
- 4%PFA/PBS 溶液を吸引除去し、2 ml の Hanks’ HEPES buffer で 2 回洗浄した。
- 2 ml の Hanks’ HEPES buffer を加え、蛍光顕微鏡で観察した。(図3 B)
Filter (wavelength/band pass)
蛍光イメージング: 550/25 nm (Ex), 605/70 nm (Em)
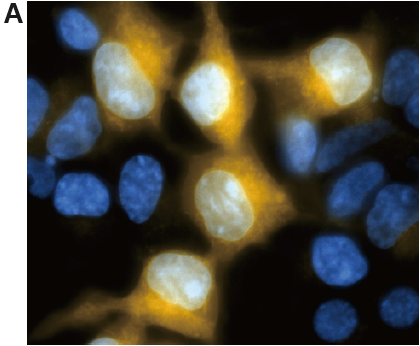
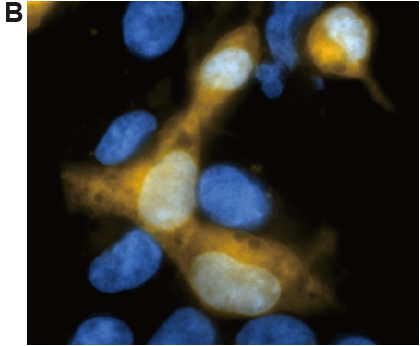
図3 HEK/LacZ 細胞とHEK 細胞の細胞数比1:1 試料のSPiDER-βGal による染色画像
A. 生細胞、B. 固定化細胞(4%PFA/PBS)
( 黄:SPiDER-βGal 由来、青:Hoechst 33342)
蛍光イメージングの結果( 図3)、β-galactosidase を強発現しているHEK/LacZ 細胞を明瞭に観測出来ました。また、固定化後も一細胞レベルでのlacZ 細胞染色像に変化はありませんでした。
フローサイトメトリーでの β-galactosidase 発現細胞の検出
- 500 μl の HEK 細胞懸濁液 (5 x 105 cells/ml) と 500 μl の HEK/LacZ 細胞懸濁液 (5 x 105 cells/ml) を 1.5 ml チューブ に混合した。
- 調製した SPiDER-βGal stock solution 1 μl を添加し、37℃で 15 分間インキュベートした。
- その細胞懸濁液をフローサイトメーターで測定した。(488 nm excitation, 530/30 nm bandpass filter)
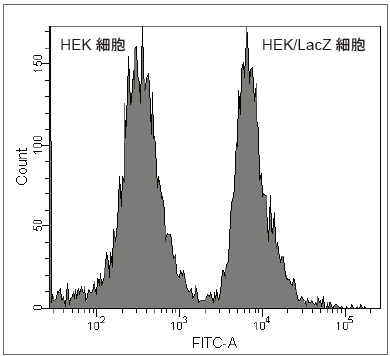
図4 HEK/LacZ 細胞とHEK 細胞の細胞数比1:1 試料のSPiDER-βGal によるフローサイトメトリーでの分別測定
フローサイトメトリーの結果( 図4)、HEK 細胞とβ-galactosidase を強発現しているHEK/LacZ 細胞を明瞭に分別出来ました。
参考文献
- T. Doura, M. Kamiya, F. Obata, Y. Yamaguchi, T. Y. Hiyama, T. Matsuda, A. Fukamizu, M. Noda, M. Miura and Y. Urano, Angew. Chem. Int. Ed., 2016, 55, 9620.
よくある質問/参考文献
SG02: SPiDER-βGal
Revised Aug., 23, 2023


 を押して省略できます。
を押して省略できます。