はじめに
近年、硫黄原子が連結したパースルフィドやポリスルフィドのようなサルフェン硫黄 (Sulfane Sulfur) を含む分子種が生体内に多く存在していることが明らかにされています。このような分子種は、硫化水素の産生や貯蔵、放出だけでなく、S-スルフヒドリル化などのタンパク質内チオールをターゲットとしたシグナル伝達にも関与していることが確認されており、非常に注目されています。また、パースルフィドやポリスルフィドは、一般的な還元物質であるシステインやグルタチオンよりも還元能が非常に高いため、生体内で高度な抗酸化物質として機能している可能性も示唆されています。
Sodium polysulfide (Na2Sn)は、サルフェン硫黄を含む分子として最も単純な構造を有するサルフェン硫黄ドナーであり、水溶液中ではpHに応じて種々の構造を有するHydrogen polysulfideとして存在します。本試薬類は、パースルフィドやポリスルフィドのようなサルフェン硫黄 (Sulfane Sulfur) を含む分子種の生体内機能の解明や解析に有用です。
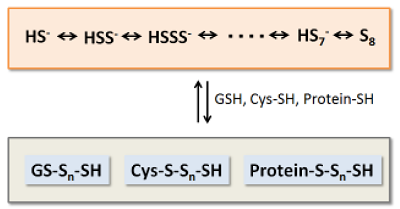
Fig. 1 サルフェン硫黄 (Sulfane Sulfur) を含む分子種
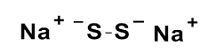
Sodium disulfi de (Na2S2)
pKa1 = 5
pKa2 = 9.7
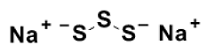
Sodium disulfi de (Na2S3)
pKa1 = 4.2
pKa2 = 7.5
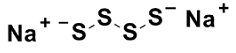
Sodium disulfi de (Na2S4)
pKa1 = 3.8
pKa2 = 6.3
※ pKa値は下記の文献を参照しています。
J. Gun et al., “Electrospray Ionization Mass Spectrometric Analysis of Aqueous Polysulfide Solutions”, Microchim. Acta, 2004, 146, 229
Fig. 2 Sodium polysulfide (Na2Sn)の構造とpKa値
内容
| SB02 | -SulfoBiotics- Sodium disulfide (Na2S2) | :100 mg x 5 |
| SB03 | -SulfoBiotics- Sodium trisulfide (Na2S3) | :100 mg x 5 |
| SB04 | -SulfoBiotics- Sodium tetrasulfide (Na2S4) | :100 mg x 5 |
| SB13 | -SulfoBiotics- Sodium Polysulfide Set | :Na2S2, Na2S3, Na2S4 各100 mg x 1 |
保存条件
0~5°Cで保存してください。
使用上の注意
本試薬類は非常に吸湿性が高いため、充分室温に戻してからご使用ください。
開封後は、窒素封入し、なるべく早くご使用ください。
使用方法
- Na2Snを秤量し、超純水(窒素バブリング処理済)を添加し、100 mmol/l Na2Sn水溶液を調製する。
(例:100 mmol/l Na2Sn水溶液;Na2S2 11 mg/ml, Na2S3 14.2 mg/ml, Na2S4 17.4 mg/ml) - この溶液を実験に応じて超純水(窒素バブリング処理済)で希釈し、ご使用ください。
- 超純水は使用前に30分間以上、窒素バブリングを行ってください。溶存酸素によって酸化される可能性があります。
- 調製したNa2Sn水溶液は、保存できません。溶液調製後、すぐにご使用ください。
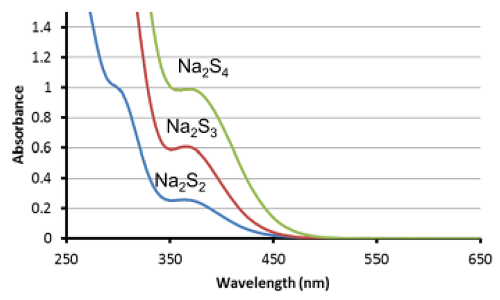
Fig. 3 1 mmol/l Sodium polysulfide (Na2Sn)水溶液の吸収スペクトル
実験例1
Hydrogen polysulfideの還元能測定(WST-8法)
- 20 μmol/l WST-8 (PBS) 1mlに10 mmol/l Na2Sn水溶液10 μlを添加した(終濃度Na2Sn 100μmol/l)。
- 室温で30分間静置した後、96-well plateの各ウェルに100 μlずつ添加し、マイクロプレートリーダーを用いて450 nm吸光度を測定した。
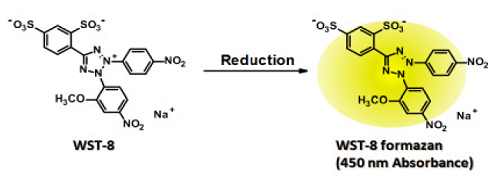
Fig. 4 WST-8還元による発色- WST-8は小社で開発した水溶性テトラゾリウム塩であり、
還元されることによって黄色のホルマザンに変化します。
- WST-8は小社で開発した水溶性テトラゾリウム塩であり、
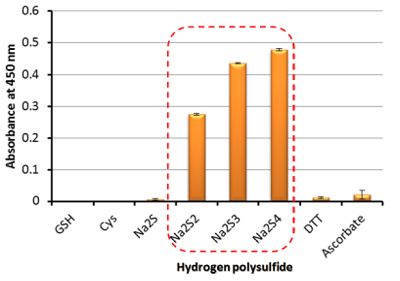
Fig. 5 各種還元物質によって生成されたWST-8
formazan由来の450nm吸光度
一般的な還元物質であるグルタチオン(GSH)やシステイン(Cys)では、還元反応によるWST-8 formazan由来の発色は観察されなかったが、Hydrogen polysulfide では発色が観察された。以上の結果から、Hydrogen polysulfide は、グルタチオン(GSH)やシステイン(Cys)よりも非常に高い還元能を有することが確認された。
実験例2
サルフェン硫黄ドナー(Na2S3)添加による細胞内サルフェン硫黄量変化の解析
- 血清入り培地(DMEM)で調製したCHO細胞懸濁液 を96-well black clear bottom plateに104 cells/well となるように播種し、CO2インキュベーター(37°C)内で一晩培養した。
- 上清を除去した後、無血清培地(DMEM)で細胞を2回洗浄した。
- 100 μmol/lサルフェン硫黄ドナーNa2S3 (Sodium trisulfide) を含む無血清培地(DMEM)100 μlを各ウェルに添加し、CO2インキュベーター(37°C)内で15分間静置した。
- 上清を除去した後、無血清培地(DMEM)で細胞を2回洗浄した。
- 20 μmol/l SSP4 (無血清培地(DMEM))100 μlをウェルに添加し、CO2インキュベーター(37°C)内で15分間静置した。
- 上清を除去した後、PBSで細胞を2回洗浄した。
- PBS 100 μlをウェルに添加した後、蛍光顕微鏡を用いて細胞を観察した。
- SSP4 (SB10; -SulfoBiotics- SSP4) はサルフェン硫黄を選択的に検出するための蛍光プローブです。
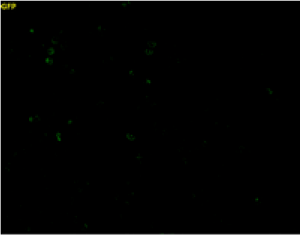 |
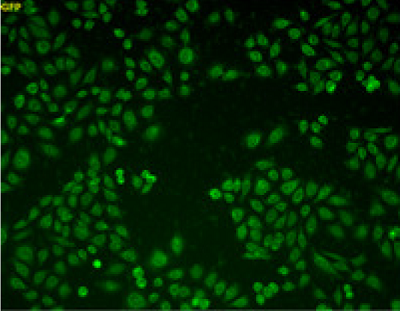 |
| 未処理 | 100 μmol/l Na2S3処理 (露光時間 1000 msec) |
Na2S3(サルフェン硫黄ドナー)で処理した細胞内に強い蛍光が観察された。
参考文献
- Y. Kimura, Y. Mikami, K. Osumi, M. Tsugane, J. Oka, and H. Kimura, FASEB J., 2013, 27, 2451.
- S. Koike, Y. Ogasawara, N. Shibuya, H. Kimura, and K. Ishii, FEBS Lett., 2013, 587, 3548.
- T. Ida, T. Sawa, H. Ihara. Y. Tsuchiya, Y. Watanabe, Y. Kumagai, M. Suematsu, H. Motohashi, S. Fujii, T. Matsunaga, M. Yamamoto, K. Ono, N. O. Devarie-Baez, M. Xian, J. M Fukuto, and T. Akaike, Proc. Natl. Acad. Sci. USA., 2014, 111, 7606.
よくある質問/参考文献
SB02_SB03_SB04_SB13: -SulfoBiotics- Sodium disulfide (Na2S2) / (Na2S3) / (Na2S4) / Sodium Polysulfide Set
Revised Apr., 05, 2024


 を押して省略できます。
を押して省略できます。










