はじめに
生殖細胞である精子は、その形成過程で核タンパク質がヒストンからプロタミンに置換されます。プロタミンはジスルフィド結合によって高次構造を形成します。これにより、体細胞核と異なり、精子核ではクロマチン構造が高度に凝集しています。
本キットは、プロタミンに多く含まれるジスルフィド結合を還元し、チオール反応性蛍光色素 (Thilol-specific Dye Blue) を還元したチオール基に結合させ、同時にDNA 染色蛍光色素 AO (Acridine Orange) により二重染色することができるキットです。UV 光 (Blue) でThilol-specific Dye Blue を励起させることで生じた蛍光エネルギーが、その近傍のDNA と結合したAO に蛍光共鳴エネルギー移動 (FRET) を起こし、精子頭部が強い緑色蛍光を発します。
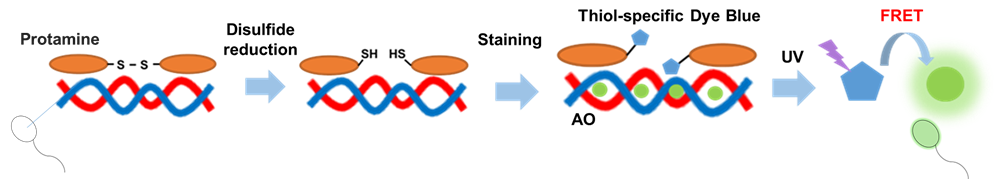
図1 精子プロタミン-DNA 複合体の染色原理
蛍光特性
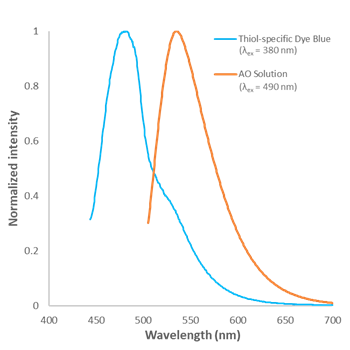
図2 Assay Buffer 中のThiol-specific Dye Blue, AO の蛍光スペクトル
キット内容
| Thiol-specific Dye Blue | 10 µl × 1 |
| AO Solution | 75 µl × 1 |
| Reducing Agent | × 1 |
| Assay Buffer | 40 ml × 1 |
保存条件
遮光、-20℃ にて保存してください。
必要なもの
- 100-1,000 µl、20-200 µl、2-20 µl、0.1-2 µl マイクロピペット
- コニカルチューブ
- Proteinase K 溶液
- Paraformaldehyde (PFA) / PBS 溶液 (4%)
- スライドガラス、カバーガラス
- 封入剤 (固定細胞用褪色防止剤)
溶液調製
Reducing Agent (RA) stock solution の調製
Reducing Agent に100 µl の超純水 を加え、ピペッティングにより溶解する。
- 溶解後は冷凍保存して下さい。調製後は6 か月間安定です。
- 凍結融解後に析出した場合は、ボルテックスにて溶解して下さい。
操作
- スライドガラスに、精液や綿棒抽出液などを塗布 (スポット 6 mm) する。
- 塗布後のサンプルは、十分に乾燥させてください。
- 夾雑物の多いサンプルの場合、事前にProteinase K 処理を行うことで精子の視認性が向上します。
- サンプルの塗布やProteinase K 処理の方法は、本製品ウェブページの「よくある質問」をご参照ください。
- 4% PFA/PBS 溶液を添加し、室温で5 分間固定化する。
- 4% PFA/PBS 溶液を除去し、Assay Buffer 30 µl で2 回洗浄する。
- RA working soution を測定するサンプル数に合わせて調製する。
Slide glass, 30 µl RA working solution/test 1 test 10 tests 100 tests RA stock solution 0.8 μl 8 μl 80 μl Assay Buffer 33 μl 330 μl 3,300 μl Total 33.8 μl 338 μl 3,380 μl - RA working solution は使用直前に調製して下さい。
- 調製後のRA working solution は保存できません。その日のうちにお使い下さい。
- 調製したRA working solution 30 µl を加え、室温で5 分間静置する。
- 上澄みを除去し、Assay Buffer 30 µl で2 回洗浄する。
- Staining solution を測定するサンプル数に合わせて調製する。
Slide glass, 30 µl Staining solution/test 1 test 10 tests 100 tests Thiol-specific Dye Blue 0.1 μl 1 μl 10 μl AO Solution 0.1 μl 1 μl 10 μl Assay Buffer 33 μl 330 μl 3,300 μl Total 33.2 μl 332 μl 3,320 μl - Staining solution は使用直前に調製して下さい。
- 調製後のStaining solution は保存できません。その日のうちにお使い下さい。
- 調製したStaining solution 30 µl を加え、室温で5 分間静置する。
- 上澄みを除去し、Assay Buffer 30 µl で2 回洗浄する。
- 封入剤 (固定細胞用褪色防止剤) を加え、カバーガラスをかけサンプルを封入する。
- 蛍光顕微鏡で観察する。
実験例
共焦点顕微鏡を用いた精液と口腔細胞の染色実験
- Proteinase K 処理した精液、および口腔細胞 (未処理) をそれぞれ塗布 (スポット 6 mm) したスライドガラスを準備した。
- 4% PFA / PBS 溶液を30 μl 添加し、室温で 5 分間インキュベートし固定化した。
- 上澄み液を除去し、Assay Buffer 30 µl で2 回洗浄した。
- 調製したRA working solution を30 μl 加え、室温で 5 分間インキュベートした。
- 上澄み液を除去し、Assay Buffer 30 µl で2 回洗浄した。
- 調製したStaining solution を30 μl 加え、室温で 5 分間インキュベートした。
- 上澄み液を除去し、Assay Buffer 30 µl で2 回洗浄した。
- 封入剤 (ProLong Glass Antifade Mountant, Thermo) を1 滴加え、カバーガラスで封入した。
- 共焦点顕微鏡 (LSM 800, Zeiss) で観察した。 (x20)

図3 精液の蛍光イメージング画像

図4 口腔細胞の蛍光イメージング画像
[検出条件]
- Blue 検出波長: Ex = 405 nm, Em = 450–510 nm, Gain: 0.15%, 550V
- Blue/Green 検出波長: Ex = 405 nm, Em = 520–530 nm, Gain: 0.15%, 550V
- Green 検出波長: Ex = 488 nm, Em = 520–530 nm, Gain: 0.10%, 550V
よくある質問/参考文献
S395: Sperm Staining Kit
Revised Oct., 10, 2024


 を押して省略できます。
を押して省略できます。

