はじめに
タンパク質濃度の検出方法として、Lowry法、Bicinchoninate法(BCA法)、Biuret法、Bradford法等が知られています。その中でもCoomassie Brilliant Blue G (CBB) (Fig.1)は高感度で反応が速いタンパク検出用試薬として、Bradford法で用いられています。Coomassie Brilliant Blue Gはタンパク質に作用し、酸性条件で青色に呈色し(λmax=595 nm) (Fig.2)、呈色反応は1分以内に終了します。生じた色素は30分以上安定なため、数分でタンパク質定量を行うことができます。本キットはマイクロプレートアッセイに対応しており、ready-to-useの状態にしたCBB溶液と検量線用のBSA溶液が含まれています。定量できるタンパク質の濃度範囲は標準法で10 μg/ml ~ 2,000 μg/ml、マイクロ法で1 μg/ml ~ 50 μg/mlです。
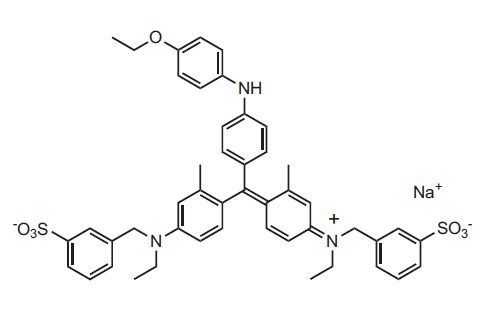
Fig.1 Coomassie Brilliant Blue G (CBB)
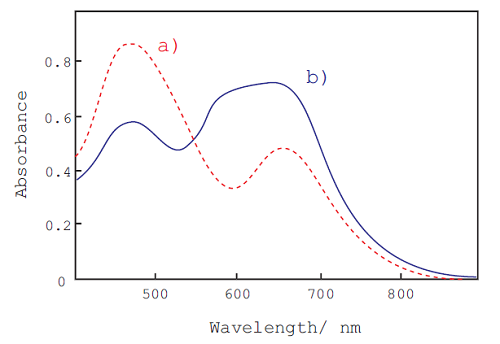
Fig.2 Coomassie Brilliant Blue Gの吸収スペクトル
a) タンパク質無し b) タンパク質あり(BSA 500 μg/ml)
キット内容
| 500 tests | CBB solution | 100 ml x 2 |
| Standard BSA solution (4,000 μg/ml) | 1.5 ml x 1 |
| 2500 tests | CBB solution | 1,000 ml x 1 |
| Standard BSA solution (4,000 μg/ml) | 1.5 ml x 2 |
保存条件
0~5°Cで保存してください。CBB solutionは0~5°Cで12ヶ月、室温では6ヶ月安定です。
必要なもの (キット以外)
- マイクロプレートリーダー(600 nmフィルター)
- 96 穴マイクロプレート
- 20μl、200μl マイクロピペッター(可変式)
- 1.5 mlチューブ
(マイクロプレートリーダーがない場合、吸光光度計でも測定できます。)
使用上のご注意
- タンパク種により感度の変化が生じますので、Table 2の変動値を考慮して下さい。更に正確な値を得るためには同じタンパク種を検量線用の標準物としてご使用下さい。
- CBB solutionは酸性です。取扱いには充分注意して下さい。
- サンプルのタンパク質の濃度が高すぎる場合、CBB solutionとの混合時に沈殿を起こす事があります。タンパク濃度が高い場合には、予め希釈してご使用下さい。
- 本キットにはガラス製容器を使用しております。保護手袋をご着用頂くなど取扱にはご注意下さい。
プロトコール
1.標準法
- Standard BSA solutionを純水で順次1/2に希釈して0 ~ 2,000 μg/mlのBSA希釈溶液を調製する (Fig.3) 。
- 1.で調製した各濃度の検量線用BSA希釈溶液、またはサンプル6 μlを各ウェルに加える。検量線はn=3にすることが望ましい。
-
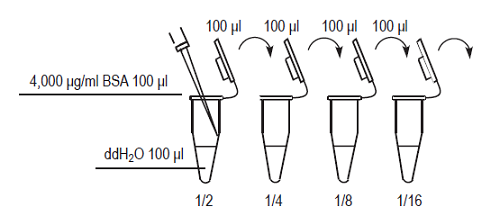
4000 μg/ml のStandard BSA solution を純水で順次1/2に希釈し、2000, 1000, 500, 250, 125, 63, 32, 0 μg/ml のBSA希釈溶液を調製する。
Fig.3 検量線作成用BSA希釈溶液の調製方法
-
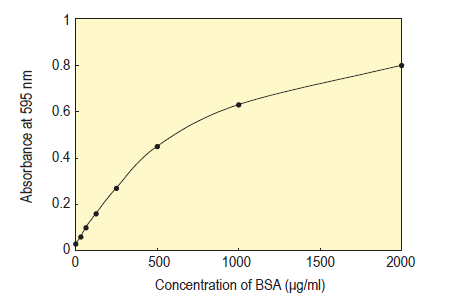
Fig. 4 Standard BSA solutionで作成した検量線
-
- CBB solution 300 μlを各ウェルに加える。吸光度測定時に影響するので、加える際に液が泡立たないように注意する。
- 室温で1分間静置する。
- プレートリーダーを使用して570 ~600 nmの吸光度を測定する。
- 各ウェルの吸光度からブランク(BSA : 0 μg/ml)の吸光度を差し引く。
- 横軸にBSAの濃度を取り、BSA希釈溶液の吸光度から検量線を作成する(Fig.4)。
- 検量線を基にサンプルのタンパク質濃度を算出する。
2.マイクロ法 [この方法は精製されたタンパク質にのみ適用できます]
- Standard BSA solution(4,000 μg/ml) 30 μlを純水で300 μlに希釈し(400 μg/ml)、更にその溶液250 μlを純水で1 mlに希釈して100 μg/ml BSA solutionを調製する。
- 100 μg/ml BSA solutionを純水で順次1/2に希釈して、0 ~ 50 μg/mlのBSA希釈溶液を調製する(Fig.5)。
- 2. で調製した各濃度の検量線用BSA希釈溶液、またはサンプル150 μlを各ウェルに加える。検量線はn=3にすることが望ましい。
- CBB solution 150 μlを各ウェルに添加後、混和する。吸光度測定時に影響するので、加える際に液が泡立たないように注意する。
- 室温で1分間静置する。
- プレートリーダーを使用して570 ~600 nmの吸光度を測定する。
- 各ウェルの吸光度からブランク(BSA: 0 μg/ml)の吸光度を差し引く。
- 横軸にBSAの濃度を取り、BSA希釈溶液の吸光度から検量線を作成する。(Fig.6)
- 検量線を基にサンプルのタンパク質濃度を算出する。
- マイクロ法では界面活性剤の影響を受けやすいので、Table 1の阻害物の影響を十分考慮し、阻害作用が大きい場合には、その除去操作を施す。
-
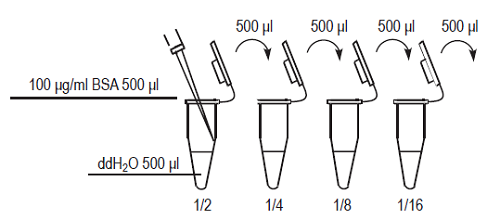
100 μg/ml のStandard BSA solution を純水で順次1/2に希釈し、50, 25, 12.5, 6.3, 3.2, 1.6, 0.8, 0 μg/ml のBSA希釈溶液を調製する。
Fig.5 検量線作成用BSA希釈溶液の調製方法
-
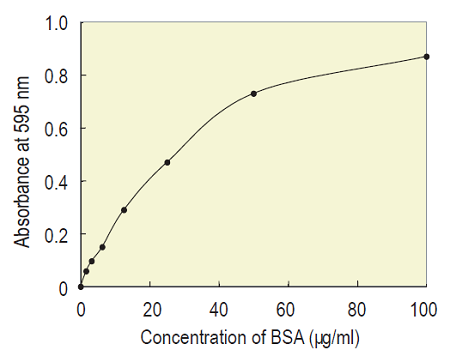
Fig.6 Standard BSA solutionで作成した検量線の例(マイクロ法)
3.セル法 [吸光光度計を用いて測定を行う場合は以下のプロトコールに従って測定してください]
- Standard BSA solutionを純水で順次1/2に希釈して0 ~ 2,000 μg/mlのBSA希釈溶液を調製する。(Fig.7)
- 1. で調製した各濃度の検量線用BSA希釈溶液、またはサンプル100 μlを加え、混合する。
- CBB solution 2.5 mlを試験管に入れる。
- 室温で30秒~1分間試験管を振って、良く混合する。
- 反応溶液を分光光度計用のセル(1 cm×1 cm)に移し替え、600 nmの吸光度を測定する。
- 測定された吸光度からブランク(BSA: 0 μg/ml)の吸光度を差し引く。
- 横軸にBSAの濃度を取り、BSA希釈溶液の吸光度から検量線を作成する(Fig.8)。
- 検量線を基にサンプルのタンパク質濃度を算出する。
-
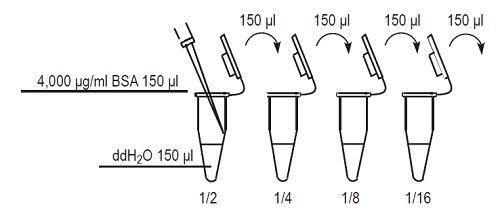
4,000 μg/ml のStandard BSA solution を純水で順次1/2に希釈し、2000, 1000, 500, 250, 125, 63, 32, 0 μg/ml のBSA希釈溶液を調製する。
Fig.7 検量線作成用BSA希釈溶液の調製方法
-
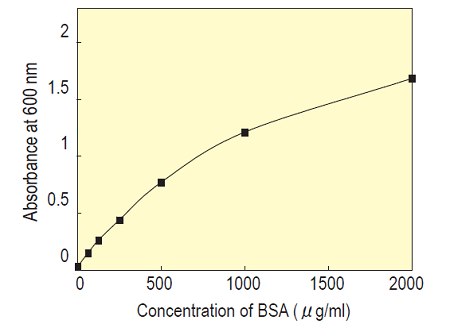
Fig.8 Standard BSA solutionで作成した検量線の例 (セル法)
阻害物質の影響
このキットの測定原理はタンパク質の疎水性部位との相互作用を利用しているため、界面活性剤は正の誤差を生じ、その他の物質も高濃度であれば誤差を生じます。標準法において、測定に影響を及ぼさない阻害物質の最大濃度をTable 1に記載します。
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
※ 無添加のBSAによる検量線との誤差が5%以内の濃度。
タンパク種による変動
本キットは検量線用のタンパク質としてBSAを用いていますが、すべてのタンパク種に対し、この検量線を使うことはできません。タンパク種による感度の変動をTable 2に示します。
| Protein | Protein vs. BSAa) |
| BSA | 1.00 |
| Chymotrypsinogen A | 0.67 |
| Transferrin | 1.02 |
| Human IgG | 0.96 |
a) 値は検量線の傾きの比を示す。(タンパク種の傾き/BSAでの傾き)
参考文献
- M. M. Bradford, Anal. Biochem., 1976, 72, 248.
よくある質問/参考文献
PQ01: Protein Quantification Kit-Rapid
Revised Dec., 06, 2023


 を押して省略できます。
を押して省略できます。

