はじめに
ミトコンドリアは、好気性生物において細胞のエネルギーであるATPを産生している重要なオルガネラの一つです。また、エネルギー産生だけでなく、脂質やアミノ酸代謝、カルシウム調節、レドックス制御にも関与しており、ミトコンドリア機能障害は、がんや老化、アルツハイマー病などの神経変性疾患、ミトコンドリア病など多くの疾病を引き起こすことが知られています。ミトコンドリア機能評価においては、他のオルガネラの影響を避けるため、分画したミトコンドリアが用いられており、近年、分画したミトコンドリアを用いた詳細な機能解析が活発になってきています。
IntactMito Fractionation Kit for Tissue は、組織からインタクトなミトコンドリアを分画することができるキットです。本キットには、ミトコンドリア分画に必要な試薬やバッファーだけでなく、遠心用チューブも同梱されています。
キット内容
10 tests
| Homogenization Buffer | 50 ml x 1 |
| Resuspension Buffer | 15 ml x 1 |
| Stabilization Buffer | 15 ml x 1 |
| Reagent A | 150 g x 2 |
| Reagent B | 5 g x 1 |
| Centrifuge Tube | 30 tubes (1 testあたり3本使用) |
保存条件
0-5 °Cで保存して下さい。
必要なもの (キット以外)
- 冷却遠心機(50 ml容器対応ローターで7200×g対応の装置)
- ポッター型20 mlホモジナイザー(材質:外筒(ガラス)、ペッスル(PTFE)、支持棒(ステンレス))
表1 その他の社内実績のあるホモジナイザー情報容量 材質 外筒 ペッスル 支持棒 5 ml ガラス PTFE ステンレス 10 ml ガラス PTFE ステンレス 30 ml ガラス PTFE ステンレス ガラス ガラス ガラス - はさみ(臓器摘出用、臓器をミンスする用)
- ピンセット(臓器摘出用)
- ビーカー
- Ice box
- カット綿
- ガラス棒2本
- 1000-5000 µl、20-200 µlのマイクロピペット
使用上のご注意
- キットの中の試薬は、室温に戻してからご使用下さい。
- 冷却遠心機は、実験前に4 °Cに設定して下さい。
- 実験器具内のCa2+等を除去するため、器具内をbuffer solutionで満たした後、その溶液をそのまま捨てる工程があります。
- 操作途中のCa2+等の混入を防ぐため、実験器具内に氷が入らないようにして下さい。
溶液調製
- 1 testあたり
Homogenization buffer solution:400 ml
Resuspension buffer solution:30 ml
Stabilization buffer solution:30 ml 必要になります。
test数に応じて、必要な量の各buffer solutionを調製してください。
Homogenization buffer solutionの調製
- 表2の通りに必要量のReagent Aを秤量する。
- 調製量の5割程度まで超純水を加え、スターラーでの撹拌や超音波装置等でReagent Aを溶解する。
- 表2の通りに必要量のHomogenization Bufferを加える。
- 調製量まで超純水を加える。
- 必要量のReagent Bを秤量する。
- 4)で調製した溶液に5)で秤量したReagent Bを加え、スターラーでの撹拌や超音波装置等でReagent Bを溶解する。
- Reagent Bを加えた後は、泡立ちやすくなりますので、ご注意下さい。
表2 Homogenization buffer solutionの調製例
| 400 ml/test | |
| Reagent A | 21.86 g |
| Homogenization Buffer | 4.40 ml |
| Reagent B | 0.40 g |
Resuspension buffer solutionの調製
- 表3の通りに必要量のReagent Aを秤量する。
- 調製量の5割程度まで超純水を加え、スターラーでの撹拌や超音波装置等でReagent Aを溶解する。
- 表3の通りに必要量のResuspension Bufferを加える。
- 調製量まで超純水を加える。
- 必要量のReagent Bを秤量する。
- 4)で調製した溶液に5)で秤量したReagent Bを加え、スターラーでの撹拌や超音波装置等でReagent Bを溶解する。
- Reagent Bを加えた後は、泡立ちやすくなりますので、ご注意下さい。
表3 Resuspension buffer solutionの調製例
| 30 ml/test | |
| Reagent A | 1.64 g |
| Resuspension Buffer (白キャップ) | 1.23 ml |
| Reagent B | 0.03 g |
Stabilization buffer solutionの調製
- 表4の通りに必要量のReagent Aを秤量する。
- 調製量の5割程度まで超純水を加え、スターラーでの撹拌や超音波装置等でReagent Aを溶解する。
- 表4の通りに必要量のStabilization Bufferを加える。
- 調製量まで超純水を加える。
- 必要量のReagent Bを秤量する。
- 4)で調製した溶液に5)で秤量したReagent Bを加え、スターラーでの撹拌や超音波装置等でReagent Bを溶解する。
- Reagent Bを加えた後は、泡立ちやすくなりますので、ご注意下さい。
表4 Stabilization buffer solutionの調製例
| 30 ml/test | |
| Reagent A | 1.64 g |
| Stabilization Buffer (赤キャップ) | 1.20 ml |
| Reagent B | 0.03 g |
操作
-臓器摘出前の事前準備-
- 冷却遠心機を4 °Cに設定する。
- 氷を入れたIce boxを用意する。
- Homogenization buffer solutionをビーカー(摘出した臓器を入れる用)に20 ml程度、Centrifuge Tube (3本/test必要)に8割程度、ホモジナイザー(外筒+ペッスルと支持棒)に8割程度を加え、氷浴上に置いておく。
- カットした綿 (2個/test必要)を直径1-1.5 cm程度に丸めて、ビーカー等に移し、Homogenization buffer solutionを20 ml程度加える。
- 4)のHomogenization buffer solutionを捨て、Resuspension buffer solutionを20 ml程度加え、氷浴上に置いておく。
- 残ったHomogenization buffer solutionとStabilization buffer solutionは、「ミトコンドリア分画実験」の操作途中でも使用するため、氷浴上で保管する。
-ミトコンドリア分画実験-
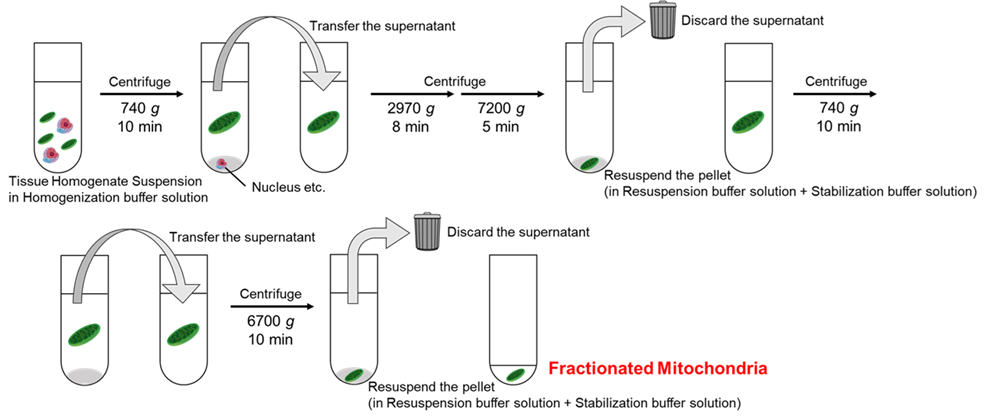 |
|
図1. 遠心操作手順 |
- 詳細な実験手順については、「操作」の項をご確認下さい。
- 操作は全て氷浴上で行って下さい。
- マウスから摘出した臓器を、「臓器摘出前の事前準備」の3)で用意したビーカーに浸す。
- 途中Homogenization buffer solutionを入れ替えながら、細かく(1 mm程度以下)なるまで、はさみでミンスする。
- Homogenization buffer solutionがほとんど濁らなくなるまで、繰り返して下さい。
目安:脳1-2回程度、肝臓2-3回程度
- Homogenization buffer solutionがほとんど濁らなくなるまで、繰り返して下さい。
- 「臓器摘出前の事前準備」の3)で用意したホモジナイザー中のHomogenization buffer solutionを捨てた後、「ミトコンドリア分画実験」の2)をホモジナイザーに移す。その後、ホモジナイザーの目盛り線までHomogenization buffer solutionを添加し、破砕する。
- 目視で確認できる大きな切片がなくなるまで、ペッスルを上下にゆっくりと動かし、往復10回程度を目安にホモジナイズして下さい。
- サンプルが複数ある場合、一度使ったホモジナイザー(外筒+ペッスルと支持棒)は洗剤で洗浄して下さい。洗浄したホモジナイザー(外筒+ペッスルと支持棒)に、Homogenization buffer solutionを8割程度加え、氷浴上に置き、次のサンプルをホモジナイズする準備をして下さい。
- 「臓器摘出前の事前準備」の3)で用意した1本目のCentrifuge Tube中のHomogenization buffer solutionを捨て、「ミトコンドリア分画実験」の3)で得られた破砕液をCentrifuge Tubeに移し、冷却遠心機にセットし、740×gで10分間 (4 °C)遠心する。
- 5 mlや10 mlホモジナイザーを用いた場合、ホモジナイズ後の破砕液(5 mlまたは10 ml)をCentrifuge Tubeに移し、全量が20 mlになるようにHomogenization buffer solutionを加えた後、遠心操作を行って下さい。
- 30 mlホモジナイザーを用いた場合、ホモジナイズ後の破砕液(30 ml)をCentrifuge Tubeに移し、全量30 mlで遠心操作を行って下さい。
- 「臓器摘出前の事前準備」の3)で用意した2本目のCentrifuge Tube中のHomogenization buffer solutionを捨て、「ミトコンドリア分画実験」の4)で得られた上清をCentrifuge Tubeに移す。冷却遠心機にセットし、2970×gで8分間 (4 °C)遠心した後、スピードを落とさず、続けて7200×gで5分間 (4 °C)遠心する。
- 2970×gで遠心後、スピードを落とさずに続けて7200×gで遠心します。そのため、2970×gでの遠心時間は長め(例:9 min)に設定し、8分間経過後、7200×g、5分間に設定を変更し、遠心して下さい。
- 上清をデカントで捨て、Centrifuge TubeにStabilization buffer solutionを10 ml加える。
- 「臓器摘出前の事前準備」の5)で用意した綿を2本のガラス棒で掴み、綿をビーカー等の壁に押し当て、Resuspension buffer solutionを絞る。
- 7)の綿を2本のガラス棒で掴み、6)で得られた沈殿物をほぐす。
- ガラス棒が沈殿物に直接触れないように注意しながら、沈殿物をほぐして下さい。
- 沈殿物が十分にほぐれ、懸濁状態になったら、使用した綿を2本のガラス棒で掴み、Centrifuge Tubeの壁に押し当て、懸濁液を絞る。
- 使用した2本のガラス棒はHomogenization buffer solutionで洗い流して下さい。
- 9)を冷却遠心機にセットし、740×gで10分間 (4 °C)遠心する。
- 「臓器摘出前の事前準備」の3)で用意した3本目のCentrifuge Tube中のHomogenization buffer solutionを捨て、「ミトコンドリア分画実験」の10)で得られた上清をCentrifuge Tubeに移す。その後、冷却遠心機にセットし、6700×gで10分間 (4 °C)遠心する。
- 上清をデカントで捨て、Stabilization buffer solutionをマイクロピペットで100 µl加える。
- 「臓器摘出前の事前準備」の5)で用意した綿を2本のガラス棒で掴み、綿をビーカー等の壁に押し当て、Resuspension buffer solutionを絞る。
- 13)の綿を2本のガラス棒で掴み、12)で得られた沈殿物をほぐす。
- ガラス棒が沈殿物に直接触れないように注意しながら、沈殿物をほぐして下さい。
- 沈殿物が十分にほぐれ、懸濁状態になったら、使用した綿を2本のガラス棒で掴み、Centrifuge Tubeの壁に押し当て、懸濁液を絞る。
- 得られたCentrifuge Tube中のミトコンドリア懸濁液は氷浴上で保存して下さい。
- 得られた分画ミトコンドリアの懸濁液を各種実験に使用する。
- 分画ミトコンドリアの希釈や評価に使用する溶液は、Stabilization buffer solutionを用いて調製して下さい。
実験例
脳由来の分画ミトコンドリアを用いたSuccinate添加による酸素消費速度(OCR)変化
- 本キットを用いて分画したミトコンドリアのOCR測定は、小社製品Extracellular OCR Plate Assay Kit (Code: E297)の取扱説明書【操作】〈浮遊細胞〉に記載している操作手順に従った。ただし、OCR測定に使用するworking solutionは、培地の代わりにStabilization buffer solutionを使用して調製した。
- Blank 3として分画ミトコンドリアをStabilization buffer solutionに懸濁(タンパク質濃度:0.5 mg/ml)し、ControlやSampleとして分画ミトコンドリアをworking solutionに懸濁(タンパク質濃度:0.5 mg/ml)したものを用意し、96穴黒色クリアボトムマイクロプレートに100 µlずつ添加した。
- Blank 1にはStabilization buffer solutionを100 µl、Blank 2にはworking solutionを100 µl添加した。
- 予め37 °Cに設定しておいたプレートリーダーの中にマイクロプレートを入れ、30分間インキュベーションした。
- Blank 1, Blank 2, Blank 3, ControlにStabilization buffer solutionを10 µlずつ添加した。
- Sampleには、Stabilization buffer solutionで希釈した110 mmol/l Succinate水溶液を10 µl添加した(終濃度:10 mmol/l)。
- 水酸化カリウム水溶液にてpH 7.2-7.6になるようにpH調整した0.25 mol/l Succinate水溶液を用いた。
- Succinate水溶液添加後、直ちにMineral Oilを1滴ずつ各ウェルに滴下した。
- 37 °Cに設定しておいたプレートリーダーの中にマイクロプレートを入れ、5分間インキュベーションした。
- 強度をタイムコースで10分毎に200分間測定した(Ex: 500 nm, Em: 650 nm, Bottomリーディング)。
- E297製品ページよりダウンロードした専用の計算シートに得られた強度の値を入力し、OCR値を算出した。
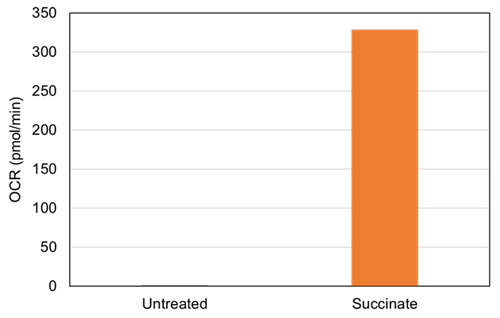 |
|
図2. SuccinateによるOCR値の変化 |
|
Succinateを添加することによって、分画したミトコンドリアのOCR値は増加した。 |
よくある質問/参考文献
MT17: IntactMito Fractionation Kit for Tissue
Revised Nov., 25, 2025


 を押して省略できます。
を押して省略できます。

