はじめに
ミトコンドリアは酸素を利用し ATP を合成することで細胞に必要なエネルギーを産出しており、重要なオルガネラの一つです1)。ミトコンドリア活性の低下や機能障害は、癌や老化、アルツハイマー病やパーキンソン病等の神経変性疾患などと密接に関わることが知られています2), 3)。 そのため、ミトコンドリア活性の指標の一つとしてよく用いられているミトコンドリア膜電位はミトコンドリア関連疾患の有望なターゲットとして広く研究されております。
低分子蛍光色素であるJC-1やTetramethylrhodamine ethyl ester (TMRE)、Tetramethylrhodamine methyl ester(TMRM)は、ミトコンドリア膜電位を観察する際に広く使用されていますが、Paraformaldehyde (PFA)固定に対応できない、光退色がおこるという課題があり、再現性の高いデータの取得を困難にします。
MT-1 MitoMP Detection Kitは、これらの課題を克服したミトコンドリア膜電位検出キットです。本キットは、JC-1 よりも感度良くミトコンドリア膜電位の変化を観察することができ、染色した細胞に対してPFA固定を行ってもミトコンドリア膜電位を検出可能です。さらに、本キットに含まれる Imaging Buffer を用いることにより、蛍光バックグラウンドを抑えながらダメージを与えにくい状態で、細胞を観察することができます。
キット内容
| MT-1 Dye | 20 μl x 3 |
| Imaging Buffer (10x) | 11 ml x 1 |
保存条件
遮光、-20℃にて保存して下さい。
必要なもの (キット以外)
- 培地またはHBSS
- マイクロピペット (100–1000 μl, 0.5–10 μl)
- マイクロチューブ
溶液調製
Imaging Buffer solution の調製
Imaging Buffer (10x)を超純水を用いて10倍に希釈する。
- 使用する当日に必要な分量を調製し、その日の内にご使用ください。
表1 容器別 Imaging Bufferの推奨使用量
| 容器 | 35-mm dish | ibidi 8-well plate |
| 必要量 | 2 ml/dish | 200 μl/well |
| 容器 | 96-well plate | Sample tube (Flow Cytometry) |
| 必要量 | 100 μl/well | 0.5 ml/sample |
MT-1 working solution の調製
MT-1 Dyeを血清入りもしくは不含培地で1000倍希釈し、MT-1 working solutionを調製する。
- Working solutionは保存できません。調製したその日の内にご使用ください。
操作
- 細胞をディッシュまたはチャンバースライドに播種し、5% CO2存在下、37 ℃設定のインキュベーター内で一晩培養する。
- 調製したMT-1 working solutionを添加する。
- インキュベーター内(37 ℃、5% CO2存在下)で、30 分間インキュベートする。
- 上澄み液を除去し、HBSSを用いて細胞を2回洗浄する。
- ミトコンドリア膜電位変化を誘導する。
- 上澄み液を除去し、HBSSを用いて細胞を2回洗浄する。
- Imaging Buffer solutionを加え、蛍光顕微鏡にて細胞を観察する。
実験例1
HeLa細胞のミトコンドリア膜電位検出
- 100 μlのHeLa細胞(2.4x105 cells/ml)を96 well black plate (clear bottom)にMEM培地(10% fetal bovine serum、1% penicilin-streptomycin)で播種し、インキュベーター内(37 ℃、5% CO2存在下)で一晩培養した。
- 培地を取り除き、MEM培地で希釈したMT-1 working solution (1000倍希釈)を100 μl添加し、インキュベーター(37 ℃、5% CO2存在下)にて30 分間インキュベートした。
- 上澄み液を取り除き、100 μlのHBSSで細胞を2回洗浄した。
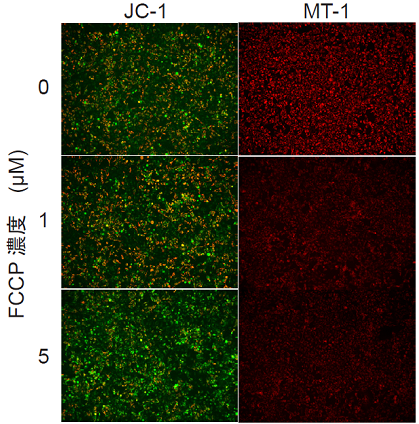
- MEM培地で希釈した0, 1, 5 μmol/lのCarbonyl cyanide p-trifluoromethoxyphenyl hydrazone (FCCP)溶液を100 μl添加し、インキュベーター内(37 ℃、5% CO2存在下)で30 分間インキュベートした。
- 上澄みを除去し、100 μlのHBSSで細胞を2 回洗浄した。
- 100 μlのImaging Buffer solutionを加え、蛍光顕微鏡で観察した。
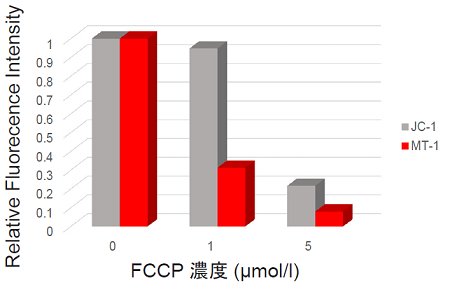
- 取得した画像の蛍光強度の数値化はKEYENCE社マクロセルカウントを用いた。
- <検出条件>
MT-1: 530-560 nm (Ex), 570-640 nm (Em)
JC-1:
Green 450-490 nm (Ex), 500-550 nm (Em)
Red 530-560 nm (Ex), 570-640 nm (Em)
図 1 FCCPで処理したHeLa細胞のミトコンドリア膜電位の検出
実験例2
アポトーシス誘導によるミトコンドリア膜電位の変化の観察
- 1 mlのHL60細胞懸濁液 (1.0x106 cells/ml, RPMI, 10% fetal bovine serum、1% penicillin-streptomycin)を5 mlチューブに加えた。
- 遠心操作(200xg, 3 分間)により培地を取り除き、RPMI 培地で希釈したMT-1 working solution (1000 倍希釈)を1 ml 添加し、インキュベーター 内(37 ℃、5% CO2存在下) にて30分間インキュベートした。
- 遠心操作(200xg, 3 分間)により上清を除去し、1 mlのHBSSで細胞を2 回洗浄した。
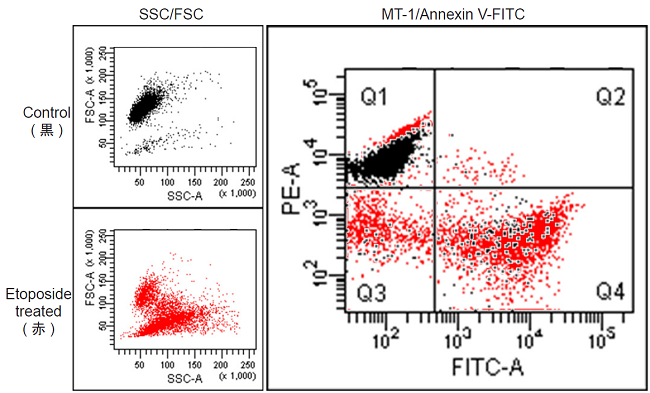
- RPMI 培地で希釈した50 μmol/lのEtoposide溶液を1 ml 添加し、インキュベーター内(37 ℃、5% CO2存在下)で 24 時間インキュベートした。
- サンプルを100 μl採取し、そこへFITC Annexin V (Becton Dickinson社製、Cat. No. 51-65874X) 5 μl添加し、室温にて15分間インキュベートした。
- 400 μlのImaging Buffer solution を加え、フローサイトメーターで観察した。
| <検出条件> Annexin V-FITC: 488 nm (Ex), 515–545 nm (Em) MT-1: 488 nm (Ex), 564–604 nm (Em) |
図2 フローサイトメーターを用いたHL60細胞のミトコンドリア膜電位検出
参考文献
- Ferri, K. F. et al., J. Exp. Med., 2000, 192, 1081–1092.
- Matsuda, N. et al., J. Cell Biol., 2010, 189, 211.
- Wang, J. L. et al., PNAS, 2000, 97, 7124–7129.
よくある質問/参考文献
MT13: MT-1 MitoMP Detection Kit
Revised May., 22, 2023


 を押して省略できます。
を押して省略できます。