はじめに
Biotin Labeling Kit - SH は SH 基を有するタンパク質、特に抗体へビオチンを標識するためのキットです。キット付属の SH-Reactive Biotin は、その分子内にマレイミド基を有しているため、SH 基を有する標的分子と混合するだけで安定な共有結合を形成します。標的タンパク質が SH 基を持っていない場合、付属の還元剤を用いて遊離 SH 基を調製することが可能です。イムノグロブリン G(IgG)のような高分子タンパク質にビオチンを標識する場合、付属の Filtration Tube を用いるとサンプルの前処理を 行うことができるだけでなく、未反応の SH-Reactive Biotin も容易に除去することができます。本キットには、標識に必要な試薬と作製したビオチン標識体を保存するための溶液が含まれています。
キット内容
| SH-Reactive Biotin | 3 tubes |
| WS Buffer | 4 ml x 1 |
| Filtraion Tube | 3 tubes |
| Reducing Agent | 3 tubes |
| Reaction Buffer | 1 ml x 1 |
保存条件
0 ~ 5℃で保存してください。ご購入後、未開封の状態で 1 年間安定です。
|
注意 SH-Reactive Biotin は、アルミラミジップに3本入っています。アルミラミジップを一旦開封した後は、未使用の SH-Reactive Biotin は、アルミラミジップに入れたまま、チャックをしっかりと閉め、-20℃で保存してください。SH-Reactive Biotin 以外は、0 ~ 5°Cで保存してください。 |
必要なもの ( キット以外 )
- 10 μl, 200 μl マイクロピペッタ-
- インキュベーター(37℃)
- マイクロチューブ(標識体保存用)
- 遠心機(マイクロチューブ用)
- DMSO
使用上の注意
- 試料溶液中に標識対象以外の分子量 10,000 以上の物質が含まれる場合は、標識反応を阻害する恐れがあります。あらかじめ試料溶液を精製して、ご使用ください。
- 試料溶液に不溶性の低分子物質が含まれる場合は、遠心して上清のみを標識反応に用いてください。
- Reducing Agent は、IgG への標識用として最適化されています。IgG 以外の S-S 結合を有するサンプルをご使用になる場合は、 S-S 結合の切断によって標識対象分子の活性が失われる場合がありますので、検討が必要です。
- 冷蔵保存中もしくは室温に戻した際に、Filtration Tube に水適様の液粒が見られることがあります。これはメンブランの乾燥防止剤が液粒化したもので、製品の性能に問題はございません。
プロトコール
-
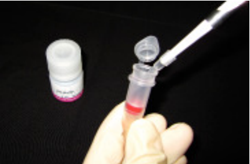
操作 1.
WS Buffer 100 µl とタンパク質 50 ~ 200 µg を含むサン プル溶液 a) を Filtration Tube に入れ、ピペッティングにより軽く混合する。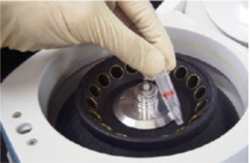
操作 2.
8,000 × g で 10 分間遠心する b)。
-
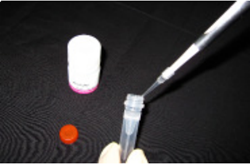
操作 3.
Reducing Agentc) に 150 µl の WS Buffer を加え、ピペッティングにより溶解する。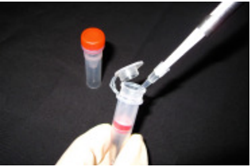
操作 4.
3 で調製した Reducing Agent 溶液 100 µl を Filtration Tube のメンブレン上に加え、メンブレン上のタンパク質と混合 する。
-

操作 5.
37°Cで 30 分間放置した後、 Reaction Buffer 100 µl を Filtration Tube に入れ、8,000 × g で 10 分間遠心する b)。
操作 6.
SH-Reactive Biotin に 10 µl の DMSO を加え、ピペッティングにより溶解する d)。
-
操作 7.
Reaction Buffer 100 µl を加えた後、SH-Reactive Biotin を含む DMSO 溶液 8 µle) を Filtration Tube のメンブレン上に加え、メンブレン上のタンパク質と混合する。
操作 8.
37℃で 30 分間放置した後、 WS Buffer 100 µl を Filtration Tube に入れ、8,000 × g で 10 分間遠心する b)。遠心後、ろ液を捨てる。
-
操作 9.
WS Buffer 200 µl を Filtration Tube に入れ、8,000 × g で 10 分間遠心する b)。 この操作を再度繰り返す。
操作 10.
WS Buffer 200 µl を Filtration Tube に入れ、10 回程度ピペッティングし、標識体を回収する f) 。 0.5 ml チューブに移し、 0 ~ 5°Cで保存する。
a) 100 µl 以下のサンプル溶液量を使用してしてください。 タンパク質溶液 100 µl 中の含有タンパク質量が 50 µg 以下である場合には、操作 1 と 2 を繰り返し、タンパク質量が 50 ~ 200 µg となるようにしてください。
b) 溶液がフィルター上に残っている場合は、さらに 5 分間遠心してください。
c) Reducing Agent がキャップの内側に付着している場合があります。開封にはご注意ください。
d) SH-Reactive Biotin はチューブの底に入っています。DMSO を加える際はチューブの底に入れ、軽くピペッティングして溶解させてください。また、SH-Reactive Biotin は溶液状態では不安定です。一旦 DMSO に溶解後は直ちに操作 7へ進んで下さい。
e) タンパク質 200 µg に標識する場合、SH-Reactive Biotin DMSO 溶液は 10 µl 全量を加えてください。
f) 標識体を回収する際は WS Buffer のご使用を推奨いたしますが、必要に応じて各種の溶液を使用してください。
標識反応
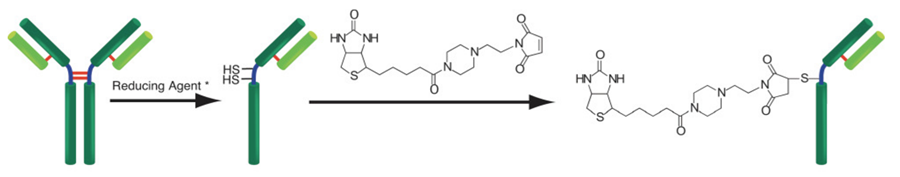
(*ヒンジ部以外のSS結合が還元される場合があります。)
Q & A
市販の抗体を用いて標識できますか?
標識できます。ただし、安定化剤としてゼラチンや血清アルブミンなどの高分子が添加されている抗体では、標識反応が阻害される場合があります。このような抗体をご使用の場合は、あらかじめアフィニティーカラムなどにより精製してご使用ください。精製法についてご不明な点がございましたらご相談ください。
このキットを使って、どのようなタンパク質にビオチンを標識することができますか ?
分子量が 50,000 以上で、反応性の SH 基を有していれば標識できます。
ビオチン標識体はどのくらい安定ですか ?
標識体の安定性はタンパク質自身の安定性に依存しますが、本キットを用いて rabbit IgG にビオチン標識した場合、4℃で 2 ヶ 月は安定であることを確認しております。ただし、長期保存する場合には等量のグリセロールを添加して、-20℃で保存してください。
タンパク質 1 分子当たりどのくらいのビオチンが標識されますか ?
ビオチン標識数はタンパク質に依存します。IgG を用いた場合、還元 IgG 1 分子あたり約 1 ~ 2 個のビオチンが標識されます。
使用できるタンパク質が少量しかないのですが ・・・
本キットはタンパク質量 50 ~ 200 µg でのご使用を推奨しておりますが、10 µg でも標識は可能です。ただし、10 µg のタンパク質を標識する場合は 50 ~ 200 µg の場合と比較して、バックグラウンドの上昇などの問題が生じる可能性があります。
このキットを使ってタンパク質以外のオリゴヌクレオチドやペプチドにビオチンをラベル化することはできますか ?
オリゴヌクレオチドやペプチドは、Filtration Tube のメンブレンフィルター孔より分子量が小さく、メンブレンフィルター上に保持することができないため、ラベル化することはできません。
ビオチン標識体を使用したアプリケーションにおいて、バックグラウンドが高くなるのですが ?
使用するサンプルによってはビオチン標識体の非特異吸着が起こる可能性があります。バックグラウンドが高い場合には、 ブロッキング工程を設けるか、またはビオチン標識体の希釈液としてブロッキング剤を用いるか、いずれかの操作を行って下さい。
ビオチン標識したタンパクを生細胞へ添加したいのですが、注意点はありますか?
細胞状態をより安定に保つため、生細胞懸濁液を調製する際は、2-10% FBS を含む PBS を用いることをお勧めします。
標識体を回収する WS Buffer は、生細胞へ影響しませんか?
WS Buffer 中には、細胞毒性を殆ど示さない量の安定化剤 ( 界面活性剤 ) を含んでいます。細胞への影響が気になる場合は、 別途任意のバッファーを用いて標識体を回収してください。
よくある質問/参考文献
LK10: Biotin Labeling Kit - SH
Revised Nov., 21, 2023


 を押して省略できます。
を押して省略できます。

