はじめに
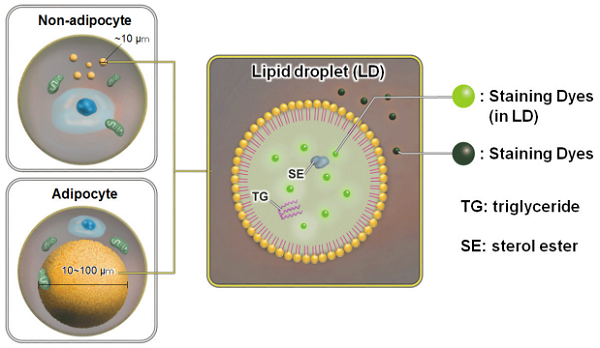
脂肪滴は脂肪細胞のみに存在するわけではなく、すべての細胞に普遍的に存在しています。最近の研究から、脂肪滴はその表面に種々のタンパク質が結合し、体内の脂質代謝制御において重要な役割を担っていることが明らかになってきています 1)。近年、脂肪滴とオートファジー 2)、細胞老化 3)、細胞分化 4) といった細胞内現象との関連性も示唆されており、脂肪滴の可視化や脂肪滴形成量の評価に関して非常に注目が集まっております。
脂肪滴の検出試薬として、Oil Red O や Nile Red が広く利用されています。しかし、Oil Red O を用いた方法は、 1) 工程が多く操作が煩雑である、2) 染色液を調製するもしくは添加する際に色素が析出し易い、3) 色素がプレートに沈着し易く、測定誤差の要因となる、4) 生細胞では使用できない等の課題があります。一方で、Nile Red を用いた方法は、Oil Red Oの様に色素が沈着したりする事はありませんが、脂肪滴選択性に乏しく測定時のバックグラウンド上昇の懸念があります。
Lipid Droplet Assay Kit は、脂肪滴を選択的かつ簡便に検出するキットです。キット付属の Staining Dye は低バックグラウンドで脂肪滴を検出できる蛍光色素であり、操作も測定サンプルに染色液を添加するだけという簡単なものです。Oil Red O のような色素沈着も起こらない為、正確なアッセイが可能です。キット付属のLoading Buffer を用いることで、細胞へのダメージを抑えながらのアッセイが可能です。本キットは、生細胞はもちろん固定化細胞にも使用することができ、フローサイトメトリーやプレートリーダーを用いた解析への応用が可能です。
内容
-
- LD05 Lipid Droplet Assay Kit - Blue Staining Dye -Blue x 1 Loading Buffer (10x) 6 ml x 1
-
- LD06 Lipid Droplet Assay Kit - Deep Red Staining Dye- Deep Red x 1 Loading Buffer (10x) 6 ml x 1
保存条件
LD05 遮光、冷蔵にて保存してください。
LD06 冷蔵にて保存してください。
必要なもの
- Dimethyl sulfoxide (DMSO)
- 培地もしくは HBSS
- マイクロピペット
- マイクロチューブ
溶液調製
DMSO stock solution の調製
Staining Dye を含むチューブに 100 μl の DMSO を加えボルテックスミキサーにより溶解し、DMSO stock solution を調製する。
- 調製後は遮光し、-20 ℃で保存して下さい (1 ヶ月間安定 )。
Loading Buffer の調製
Loading Buffer (10x) を、超純水を用いて 10 倍に希釈する。
- 調製する際は、使用する当日に必要な分量を調製してください。
- 希釈液は、その日の内にご使用ください。
Working solution の調製
調製した DMSO stock solution を希釈した Loading Buffer を用いて、200 倍に希釈する。
- 調製する際は、使用する当日に必要な分量を調製してください。
- Working solution は、その日の内にご使用ください。
操作
- 細胞をディッシュまたは 96-well Black プレートに播種し、37 ℃、5% CO2 インキュベーター内で一晩培養する。
- 培地を除去し、HBSS を用いて細胞を 2 回洗浄する。
- 調製した Working solution を加え、37 ℃、5% CO2 インキュベーター内で 1–2 時間インキュベートする。
- 上清を除去し、HBSS を用いて細胞を 2 回洗浄する。
- プレートリーダーやフローサイトメーターを用いて細胞を観察する。
- プレートリーダーで検出する際には、下記の表 1 に示す推奨フィルターをご使用ください。
フローサイトメーターで検出する際には、下記表 2 に示す推奨フィルターをご使用ください。
推奨フィルター以外で測定した場合、検出感度が下がる可能性がございます。
-
表1プレートリーダー使用時の推奨フィルター Lipid Droplet Assay Kit - Blue No. Excitation filter Emission filter 1 360 nm (20) 430 nm (35) 2 360 nm (20) 460 nm (20) 3 380 nm (20) 430 nm (35) 4 380 nm (20) 460 nm (20) Lipid Droplet Assay Kit - Deep Red No. Excitation filter Emission filter 1 590 nm (20) 635 nm (35) 2 590 nm (20) 670 nm (25) 3 620 nm (10) 670 nm (25)
-
表2 フローサイトメーターの推奨フィルター Lipid Droplet Assay Kit - Blue Excitation laser Emission filter 405 nm 425-475 nm Lipid Droplet Assay Kit - Deep Red Excitation laser Emission filter 640 nm 650-670 nm
実験例1
オレイン酸 (OA) もしくは Triacsin C (TC) により誘導を行った HepG2 細胞内の脂肪滴測定
- 96 well black プレートに HepG2 細胞 (5×103 cells/well) を播種し、37 ℃、5% CO2 インキュベーター内で 一晩培養した。
- 上清を除去し、HBSS で細胞を 2 回洗浄した。
- 200 μmol/l OA もしくは 5 µmol/l TC を含む血清入り培地をウェルに添加し、37 ℃ で一晩培養した。
- 上清を除去し、HBSS で細胞を 2 回洗浄した。
- 調製した Working solution を添加し、37 ℃ で 2 時間インキュベートした。
- 上清を除去し、HBSS で細胞を 2 回洗浄した。
- HBSS を添加し蛍光プレートリーダーを用いて測定した。
- 脂肪滴形成誘導剤としてオレイン酸を使用した。
- 脂肪滴形成阻害剤として Triacsin C を使用した。
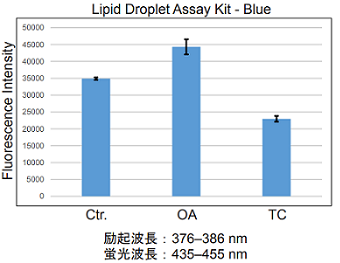
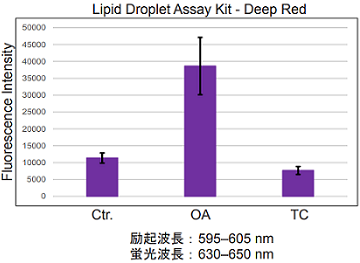
図1 HepG2細胞内の脂肪滴の増減
実験例2
オレイン酸 (OA) もしくは Triacsin C (TC) による誘導を行った HeLa 細胞内脂肪滴の測定
- 6 well プレートに HeLa 細胞 (2.5×105 cells/ml) を 200 μmol/l OA もしくは 5 µmol/l TC を含む DMEM 培地 (10% fetal bovine serum, 1% penicillin-streptomycin) で播種し、37 ℃、5% CO2 インキュベーター内で 一晩培養した。
- 上清を除去し、HBSS で細胞を 2 回洗浄した。
- 調製した Working solution を添加し、37 ℃ で 2 時間インキュベートした。
- PBS で細胞を 2 回洗浄した。
- Tripsin-EDTA を用いて細胞を回収した。
- 上清を除去し、HBSS で細胞を懸濁させた。
- 懸濁液をフローサイトメーターを用いて解析した。
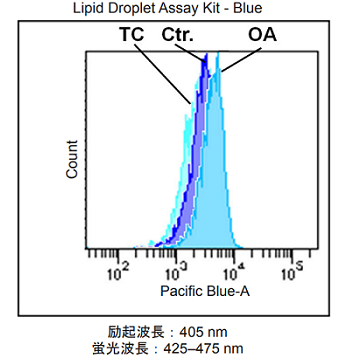
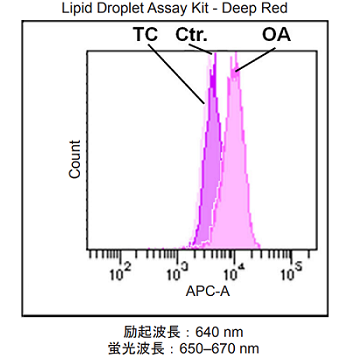
図2 HeLa細胞内の脂肪滴の増減
参考文献
- Fujimoto, T. et al., Histochem Cell Biol., 2008, 130(2), 263–279.
- Singh, R. et al., Nature, 2009, 458(7242), 1131–1135.
- Yokoyama, M. et al., Cell Reports, 2014, 7(5), 1691–1703.
- Oka, M. et al., Cells, 2019, 8(4), 373
よくある質問/参考文献
LD05_LD06: Lipid Droplet Assay Kit - Blue / Deep Red
Revised Jun., 22, 2023


 を押して省略できます。
を押して省略できます。




