はじめに
脂肪滴は、トリアシルグリセロールやコレステロールエステルなどの中性脂肪が単分層のリン脂質一重膜によって取り囲まれた構造体です。脂肪滴は脂肪細胞のみに存在するわけではなく、すべての細胞に普遍的に存在しています。最近の研究から、脂肪滴はその表面に種々のタンパク質が結合し、体内の脂質代謝制御におい て重要な役割を担っていることが明らかになってきています1)。近年、脂肪滴とオートファジー2)、細胞老化3) といった細胞内現象との関連性も示唆されており、脂肪滴の形成・成長・融合・分解のメカニズムをより詳細に解明するツールが待ち望まれています。Lipi シリーズ色素は、脂肪親和性の強い低分子蛍光色素であり、疎水性環境下で蛍光が増強し、脂肪滴を洗浄操作なしで明瞭に観察することができます4)。
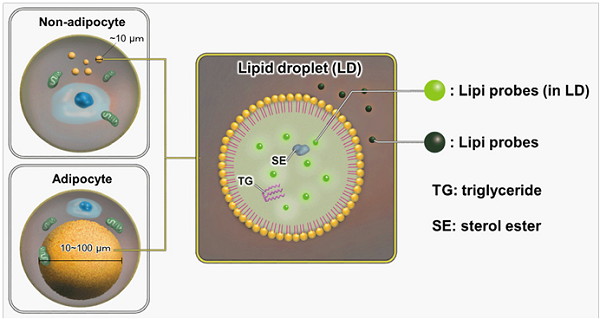
図 1 脂肪滴と Lipi シリーズ色素染色イメージ
内容
| LD01 Lipi-Blue | 10 nmol x 1 |
| LD02 Lipi-Green | 10 nmol x 1 |
| LD03 Lipi-Red | 100 nmol x 1 |
| LD04 Lipi-Deep Red | 10 nmol x 1 |
保存条件
- LD01 遮光、冷暗所にて保存してください。
- LD02 遮光、冷暗所にて保存してください。
- LD03 遮光、冷暗所にて保存してください。
- LD04 冷暗所にて保存してください。
必要なもの
- Dimethyl sulfoxide (DMSO)
- PBS
- マイクロピペット
補足資料
Lipiシリーズ色素の蛍光色素
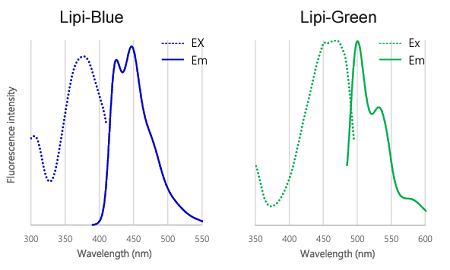
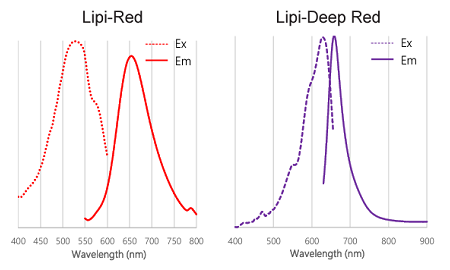
図2 Lipi-Blue, Lipi-Green, Lipi-Red, Lipi-Deep Red の励起、蛍光スペクトル
溶液調製
Lipi シリーズ色素 DMSO stock solution の調製
- Lipi-Blue
10 nmol を含むチューブに 100 μl の DMSO を加えボルテックスミキサーにより溶解し、0.1 mmol/l DMSO stock solution を調製する。 - Lipi-Green
10 nmol を含むチューブに 100 μl の DMSO を加えボルテックスミキサーにより溶解、0.1 mmol/l DMSO stock solution を調製する。 - Lipi-Red
100 nmol を含むチューブに 100 μl の DMSO を加えボルテックスミキサーにより溶解、1 mmol/l DMSO stock solution を調製する。 - Lipi-Deep Red
10 nmol を含むチューブに 100 μl の DMSO を加えボルテックスミキサーにより溶解し、 0.1 mmol/l DMSO stock solution を調製する。
- 調製後は遮光し、-20 oCで保存して下さい(1ヶ月間安定)。
- Lipi-Blue はチューブに無色フィルム状で付着しており、目視では確認しづらい状態となっております。 調製の際には、溶液を加えボルテックスミキサーにてしっかり混合しお使いください。
Lipi シリーズ色素 working solution の調製
- Lipi-Blue
0.1 mmol/l DMSO stock solution を PBS または無血清培地で希釈し、0.1–0.5 μmol/l working solution を調製する。 - Lipi-Green
0.1 mmol/l DMSO stock solution を PBS または無血清培地で希釈し、0.1–0.5 μmol/l working solution を調製する。 - Lipi-Red
1 mmol/l DMSO stock solution を PBS または無血清培地で希釈し、1–5 μmol/l working solution を調製する。 - Lipi-Deep Red
0.1 mmol/l DMSO stock solution を PBS または無血清培地で希釈し、 0.1 μmol/l working solution を調製する。
- 調製後はその日の内にご使用下さい。
- 無血清培地の代わりに、血清入り培地もご使用いただけます。
操作
- 細胞をディッシュまたはチャンバースライドに播種し、37 oC、5% CO2 インキュベーター内で一晩培養する。
- 培地を除去し、PBS を用いて細胞を 2 回洗浄する。
- 調製した working solution を加え、37 oC、5% CO2 インキュベーター内で 30 分間インキュベートする。
- 落射型顕微鏡で観察の場合、バックグラウンド蛍光の低減のため、細胞洗浄を行うことをお勧めします。
- 蛍光顕微鏡にて細胞を観察する。
- 推奨フィルターは下記の通りです。色素に合ったフィルターをご使用ください。
Lipi-Blue: 励起波長 405 nm, 蛍光波長 450–500 nm
Lipi-Green: 励起波長 488 nm, 蛍光波長 500–550 nm
Lipi-Red: 励起波長 561 nm, 蛍光波長 565–650 nm
Lipi-Deep Red: 励起波長 640 nm, 蛍光波長 650–700 nm - 蛍光が確認できない場合の対処法
1. 顕微鏡の倍率 : 細胞によっては脂肪滴が小さく、確認が困難な場合があります。x40 以上の倍率での観察をお勧めします。
2. インキュベーション時間 : 試薬添加後に 1–2 時間インキュベートする。
3. 試薬濃度 : 推奨濃度範囲でも蛍光が観察されない場合、さらに高濃度で染色する。
Lipi-Blue, Lipi-Green: 1 µmol/l、Lipi-Red: 10 µmol/l、 Lipi-Deep Red: 0.5 µmol/l
※ 色素濃度を上げすぎた場合、バックグラウンドが上昇することがあります。
4. ポジティブコントロール : オレイン酸処理した細胞によるポジティブコントロールをご準備されることをお勧めします。
- 推奨フィルターは下記の通りです。色素に合ったフィルターをご使用ください。
実験例1
オレイン酸による脂肪滴導入 (HeLa 細胞 )
- μ-Slide 8 well に HeLa 細胞を播種し、37 oC、5% CO2 インキュベーター内で一晩培養した。
- 上清を除去し、無血清培地で 2 回洗浄した。
- 200 μmol/l オレイン酸を含む血清入り培地をウェルに添加し、37 oC で一晩培養した。
- 上清を除去し、無血清培地で 2 回洗浄した。
- 無血清培地で調製した working solution を添加し、37 oC で 30 分間インキュベートした。
- 蛍光顕微鏡にて観察した。
|
|
|
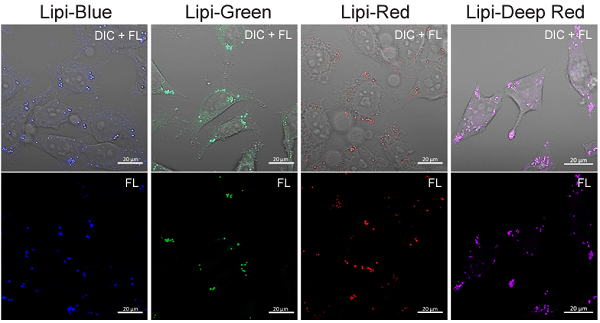
| ・Lipi-Blue ( 染色濃度 : 0.1 μmol/l) ( 励起波長 : 405 nm、蛍光波長 : 450–500 nm) ・Lipi-Green ( 染色濃度 : 0.1 μmol/l) ( 励起波長 : 488 nm、蛍光波長 : 500–550 nm) |
・Lipi-Red Scale bars: 20 μm |
図3 脂肪滴形成を誘導した HeLa 細胞の染色画像
実験例2
Triacsin C による脂肪滴形成阻害 (HepG2 細胞 )
- μ-Slide 8 well に HepG2 細胞を播種し、37 oC、5% CO2 インキュベーター内で一晩培養した。
- 上清を除去し、無血清培地で 2 回洗浄した。
- 5 μmol/l Triacsin C を含む血清入り培地をウェルに添加し、37 oC で一晩培養した。
- 上清を除去し、無血清培地で 2 回洗浄した。
- 無血清培地で調製した working solution を添加し、37 oC で 30 分間インキュベートした。
- 蛍光顕微鏡にて観察した。
|
|
|
|
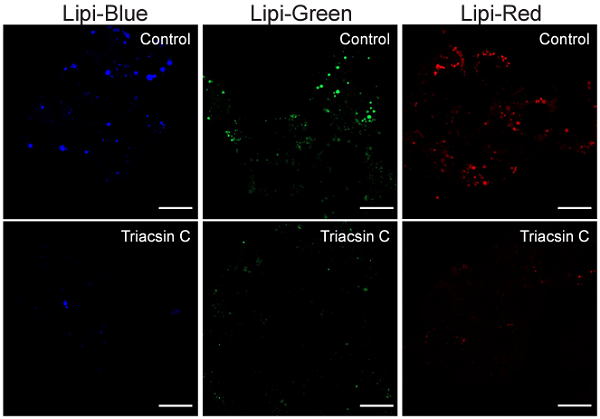
・Lipi-Blue ・Lipi-Green |
・Lipi-Red
|
図 4 脂肪滴形成を阻害した HepG2 細胞の染色画像
参考文献
- Fujimoto, T. et al., Histochem Cell Biol., 2008, 130(2), 263–279.
- Singh, R. et al., Nature, 2009, 458(7242), 1131–1135.
- Yokoyama, M. et al., Cell Reports, 2014, 7(5), 1691–1703.
- Tatenaka, Y. et al., Biochemistry., 2019, 58(6), 499-503.
LD01_LD02_LD03_LD04: Lipi-Blue / Green / Red / Deep Red
Revised Jun., 21, 2023


 を押して省略できます。
を押して省略できます。