はじめに
鉄イオンに依存した脂質過酸化物の蓄積により引き起こされるフェロトーシスがStockwellらに提唱されてから10年以上経過し、これまでにフェロトーシスに関する様々な研究がなされています。遊離した二価鉄 (Fe2+) がフェントン反応により活性酸素を発生させ、脂質が酸化されることから、フェロトーシスは鉄依存性の細胞死であることが明らかになってきています1)。また最近では、脂質酸化により、リソソームの膜が損傷し、リソソーム中の鉄が漏出することによって、他の細胞小器官へ脂質酸化が広がっていくことが報告されています2)。
Lyso-FerroRedは細胞内のリソソームの鉄を検出することができます。試薬を培養細胞に添加すると細胞膜を透過し、リソソームのFe2+と選択的に反応し強い蛍光を発します。Lyso-FerroRedにはキレート能はなく、Lyso-FerroRedとFe2+は非可逆的に反応するため、Fluo 3のようなカルシウムプローブの検出原理とは異なります。
内容
Lyso-FerroRed 35 nmol×1
保存条件
遮光、冷暗所にて保存してください。
必要なもの
– 蛍光顕微鏡、蛍光プレートリーダーもしくはフローサイトメーター)
– インキュベーター(37℃)
– マイクロピペット(100–1000 µl, 20–200 µl, 0.5–10 µl)
– コニカルチューブ
– 培地またはHBSS (Hanks' balanced salt solution)
使用上のご注意
・Lyso-FerroRedはチューブに無色フィルム状で付着しており、目視では確認しづらい状態となっております。
・輸送中の振動等により、内容物がスクリューキャップマイクロチューブ壁面やキャップ裏面に付着している場合がありますので、
開封前に内容物を底面に落としてからご使用ください。
・検出器毎の推奨測定波長は表1を参照してください。
| 検出器 | 蛍光顕微鏡 | 蛍光プレートリーダー | フローサイトメーター |
| 測定波長 |
・共焦点レーザー顕微鏡 EX/Em: 564/565–620 nm ・落射型顕微鏡 TRITCフィルター |
Excitation: 540–560 Emission: 570–590 nm |
EX/Em: 564/565-620 nm |
表1 検出器別の推奨測定波長
溶液調製
1 mmol/l Lyso-FerroRed DMSO stock solutionの調製
Lyso-FerroRed 35 nmolを含むチューブに35 μlのDMSOを加えピペッティングにより溶解し、1 mmol/l DMSO stock solutionを調製する。
- 調製後は遮光し、-20 °Cで保存して下さい (1ヶ月間安定)。
1 μmol/l Lyso-FerroRed working solutionの調製
Lyso-FerroRedを無血清培地もしくはHBSSで1000倍希釈し、1 μmol/l working solutionを調製する。
- working solutionは保存できません。調製したその日の内にご使用ください。
- 容器別のworking solution量は表2を参考にして下さい。
| 容器 | 35-mm dish | ibidi 8-well plate | 96-well black plate (clear bottom) |
| 必要量 | 2 ml | 200 μl/well | 100 μl/well |
表2 容器別working solutionの推奨使用量
操作
- 細胞をディッシュに播種し、5% CO2存在下、37°Cで培養一晩する。
- 培地を取り除き、無血清培地もしくはHBSSを用いて2回洗浄する。
- 上清除去後、薬剤等を含んだ無血清培地もしくはHBSS溶液で適切な時間処理する。
- 上清を吸引除去し、無血清培地もしくはHBSSで細胞を2回洗浄する。
- 上清除去後、表2を参考に、適切な量のLyso-FerroRed working solutionを添加し、5% CO2インキュベーター内に37°Cで30分インキュベートとする。
- Working solutionを吸引除去し、HBSSで細胞を2回洗浄する。
- 各蛍光検出器で検出する。
実験例
硫酸アンモニウム二価鉄を取り込ませたHT-1080細胞のリソソーム内鉄検出
- 検出容器にHT-1080細胞 (MEM, 10% fetal bovine serum,1% penicillin-streptomycin)を播種し、インキュベーター内 (37℃、5% CO2存在下)で一晩培養した。
- 96 well Black plate (1×104 cells/well), ibidi 8-well plate (3×104 cells/well), 35-mm dish (3×105 cells/well)
- 上清を取り除き、無血清培地で細胞を2回洗浄し、各容器を満たすのに必要な無血清培地を添加した。
- 96 well Black plate (100 μl/well), ibidi 8-well plate (200 μl/well), 35-mm dish (2 ml/well)/li>
- 10 mmol/l となるように超純水で硫酸アンモニウム鉄 (II)溶液を調製した。
- 10 mmol/l 硫酸アンモニウム鉄 (II)溶液を操作2.の1/100量 をウェルに添加し(終濃度 100 μmol/l) 、溶液を均一にするため、ウェル内の溶液全量を一度マイクロピペットで吸い上げ、再び同じウェルにゆっくり戻した。
- 96 well Black plate (1 μl/well), ibidi 8-well plate (2 μl/well), 35-mm dish (20 μl/well)
- 硫酸アンモニウム鉄(II)を添加する際は操作4の様に行って下さい。マイクロチューブなどに予め無血清培地で100 μmol/l 硫酸アンモニウム鉄 (II)溶液を調製し細胞に添加する方法では、ボルテックスやピペッティングによる混合操作で沈殿が生じる可能性があります。
- 5% CO2 存在下、インキュベーター内に37℃で 30分静置した後、硫酸アンモニウム鉄 (II)溶液を除き、無血清培地 で2回洗浄した。
- Lyso-FerroRed (1 μmol/l) 及び 2,2'-bipyridyl (Bpy) (1 mmol/l)を含む無血清培地溶液を添加し、5% CO2 存在下、37℃で30分間インキュベートした。
- 上清除去後、HBSSで細胞を2回洗浄後、容器をHBSSで満たした。
- 蛍光シグナルをプレートリーダーもしくはフローサイトメーターで検出し、蛍光顕微鏡で細胞を観察した。
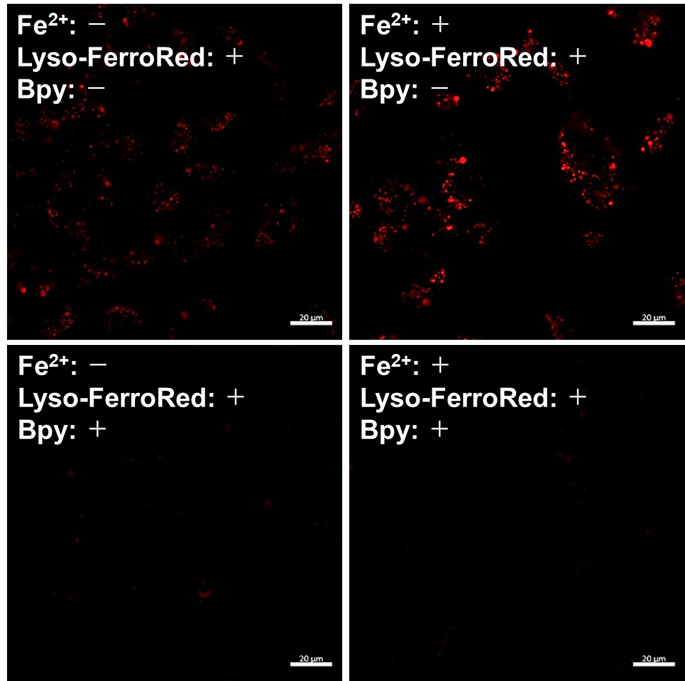 |
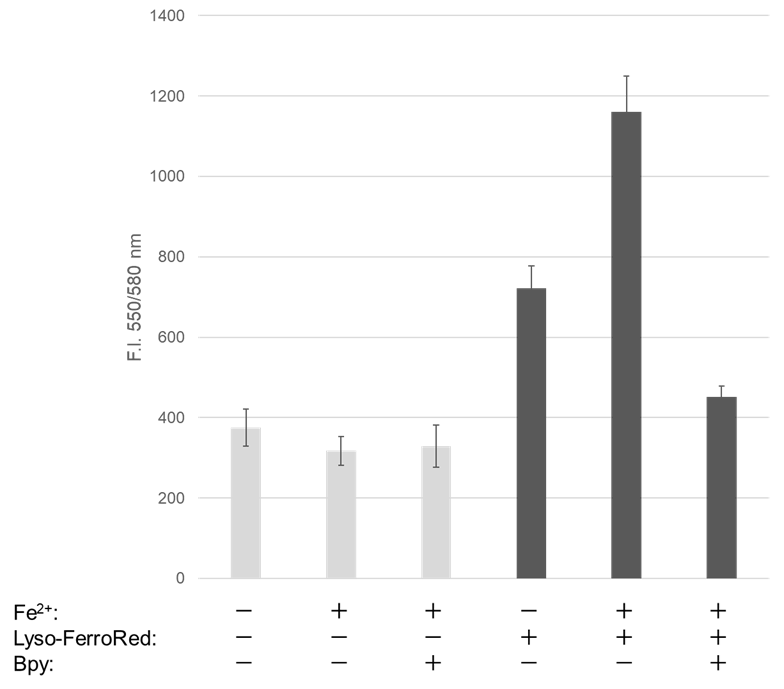 |
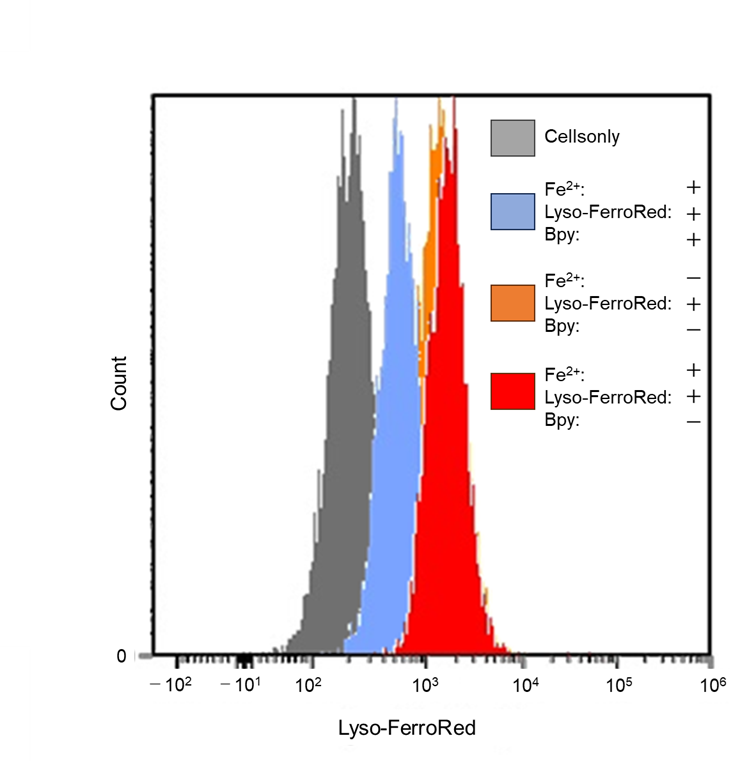 |
|
検出器: 共焦点レーザー顕微鏡 |
検出器: 蛍光プレートリーダー |
検出器: フローサイトメーター Ex/Em: 565/565–617 nm |
図1 共焦点レーザー顕微鏡、蛍光プレートリーダー、フローサイトメーターにおけるHT-1080細胞のリソソーム内鉄の検出
参考文献
1)Brent R. Stockwell et al., Cell, 2012, 149, 1060.
2)K. Yamada et al., Nature Communications, 2025, 16, 2554.
L270: Lyso-FerroRed
Revised Aug., 18, 2025


 を押して省略できます。
を押して省略できます。