はじめに
近年、細胞から分泌される細胞外小胞(Extracellular vesicle ; EV)の一種であるエクソソームががんの悪性化や転移に促進的に関与することが明らかとなり、注目を集めています。エクソソームによる細胞間コミュニケーションを解析するためには、細胞内取り込みをモニタリングすることが重要であり、様々な蛍光標識技術が用いられています。本製品はエクソソーム内の蛋白質を染色し、細胞内取り込みを可視化できる蛍光色素です。蛍光色はGreen, Red, Deep Redを取り揃えており、多重染色による様々な実験系への適応が可能です。
内容
| 品コード及び製品名 | 染色用色素 | Filtration Tube |
| EX04 : ExoSparkler Exosome Protein Labeling Kit-Green | Protein Dye-Green x 1 本 | x 5 本 |
| EX05 : ExoSparkler Exosome Protein Labeling Kit-Red | Protein Dye-Red x 1 本 | x 5 本 |
| EX06 : ExoSparkler Exosome Protein Labeling Kit-Deep Red | Protein Dye-Deep Red x 1 本 | x 5 本 |
保存条件
遮光、 0 – 5 °Cで保存してください。
必要なもの
- Dimethyl sulfoxide (DMSO)
- PBS
- マイクロピペット
- マイクロチューブ
- 遠心機
溶液調製
Protein Dye stock solution の調製
Protein Dye-Green, Red, Deep Red の入ったチューブに DMSO 10 μl を入れ、ボルテックスミキサーで良く溶解する。
溶解後の Protein Dye stock solution を保存する際には 2 μl ずつを新しいチューブに分注し、- 20 °C以下で保存してください。
- Protein Dye-Greenはチューブ底面に無色フィルム状に付着しており、目視での確認はできません。
- 凍結融解の繰り返しにより色素が劣化するため、凍結融解後は保存できません。
操作
細胞準備
- 細胞をディッシュに播種し、5% CO2 存在下、37°Cで任意の時間培養する。
エクソソーム染色
| タンパク質量 | 1 – 10 μg |
| 粒子数 | 10 – 100 x 108 個 |
- 上記エクソソーム量は超遠心法で得たエクソソームを用いた際の目安になります。
- エクソソームの精製条件や由来細胞種により染色に必要なエクソソーム量は異なるため、 はじめて染色される際には必ず使用するエクソソーム量をご検討ください。
- ポリマー沈殿法により得たエクソソームは、残存するポリマーの影響を受けるため、 本キットでの染色はできません。
- PBSで懸濁したエクソソーム 100 μl をマイクロチューブに入れる。
- Protein Dye stock solution 2 μl を操作を 2. の溶液に入れボルテックスミキサーで良く攪拌する。
- 37°Cで30分間インキュベーションする。
- フィルトレーションチューブにインキュベーション後の溶液を全量移す。
- 室温で3000 x g、5分間遠心する。
- PBS 100 μl をフィルトレーションチューブに入れる。
- 室温で 3000 x g、5分間遠心する。
- 操作 7. および 8. を再度繰り返す。
- 残存する溶液を通液するために再度室温で 3000 x g、5分間遠心する。
- 3000 x g 以上で遠心操作を行うとエクソソームもフィルターを通過し回収量が低下します。
溶液が残存する際には溶液がすべて通過するまで遠心操作を繰り返してください。
- 3000 x g 以上で遠心操作を行うとエクソソームもフィルターを通過し回収量が低下します。
- PBS 50 μl をフィルトレーションチューブに入れ、フィルター上の未反応色素に直接チップの先が触れないよう注意深くピペッティングし、回収した染色済みエクソソームを、新しいマイクロチューブに移す。
- フィルター上には未反応の色素も保持されているため、 直接チップの先で残存色素に触れるとコンタミの原因になります。
フィルター上に保持された未反応色素
⇒この部分にチップの先が直接触れないようにPBSを入れて回収する
細胞へのエクソソームの添加
- 培地を取り除き、PBSで1回洗浄する。
- PBSを取り除き、新しい血清含有培地を加える。
- 回収した染色済みエクソソーム 1 – 50 μl を細胞に添加し、5% CO2 存在下、37°Cで 1 – 24 時間インキュベーションする。
- 上澄みを取り除き、PBS で2回洗浄する。
- PBSを取り除き、新しい血清含有培地を加え、蛍光顕微鏡で観察する。
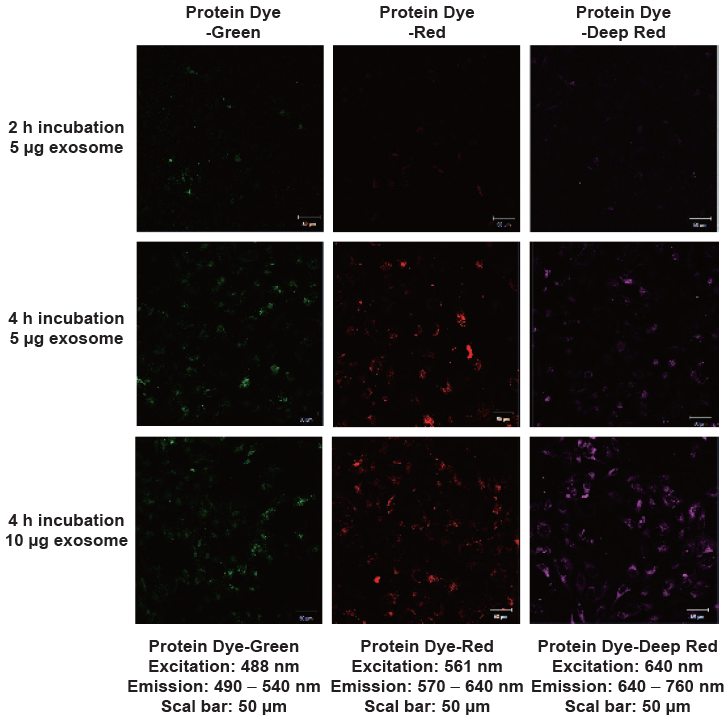
実験例
HeLa細胞を用いたエクソソーム添加量、インキュベーション時間による蛍光強度変化観察
- μ-slide 8 well plate (ibidi) に HeLa 細胞(1.25 x 104 cells/well)を播種し、5%CO2 存在下、37 °Cで一晩インキュベーションした。
- 培地を除き、PBSで1回洗浄し、新たな 10% FBS 含有 DMEM 培地を 200 μl 加えた。
- エクソソーム※ を各種色素で染色し(5, 10 μg protein 相当量。粒子数では 50, 100 x 108 個)、全量を HeLa 細胞に添加した。
- 5% CO2 存在下、37°Cで 2もしくは 4 時間インキュベーションした。
- 培地を取り除き、PBSで2回洗浄した。
- PBSを取り除き、新しい10% FBS 含有 DMEM 培地を 200 μl 入れ、蛍光顕微鏡で観察した。
- エクソソームは浮遊性 HEK293 細胞の培養上清から超遠心法で精製し、使用した。タンパク量は BCA 法、粒子数はナノ粒子トラッキング解析法 (NTA) にて測定した。
|
※ 上記データは京都大学大学院工学研究科高分子化学専攻 秋吉一成先生のご支援のもと取得いたしました。 |
EX04_EX05_EX06: ExoSparkler Exosome Protein Labeling Kit-Green / Red / Deep Red
Revised May., 12, 2023


 を押して省略できます。
を押して省略できます。