はじめに
酸素は、主にミトコンドリアの酸化的リン酸化でアデノシン三リン酸 (ATP) が産出される過程で消費されるため、その酸素消費速度 (OCR: Oxygen Consumption Rate) はミトコンドリア機能解析の指標となっています。がん細胞では酸化的リン酸化より非効率な解糖系を用いてATPを産出することが知られています。また、免疫細胞では酸化的リン酸化が優位の場合、抗腫瘍効果を阻害するのに対し、解糖系が優位の場合は、抗腫瘍効果を促進することが分かってきています。それらのエネルギー代謝の指標として、細胞のOCRが測定されています。
Extracellular OCR Plate Assay Kitは、培養細胞のOCRを測定することができるキットで、培地中の酸素濃度が低下すると、りん光強度が高くなる特性を持つOxygen Probeと空気中の酸素流入を遮断するためのMineral Oilを同梱しています。本キットは、専用の装置や培地、プレート等を必要とせず、汎用の蛍光プレートリーダーやマイクロプレートでの測定が可能です。
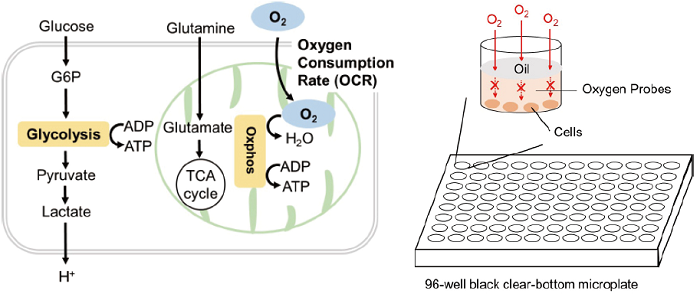
図1 Extracellular OCR Plate Assay Kit の測定原理
キット内容
| Oxygen Probe | 110 μl x 1 |
| Mineral Oil | 10 ml x 1 |
保存条件
-20 oC で保存して下さい。
必要なもの (キット以外)
- マイクロプレートリーダー (温度調節機能がついているもの)
- 96穴黒色クリアボトムマイクロプレート
- 20 - 200 μlのマルチチャンネルピペット
- 100 - 1000 μl、20 - 200 μl、2 - 20 μl マイクロピペット
- 1.5 ml マイクロチューブ
- コニカルチューブ
- ヒートブロックもしくは恒温槽
使用上のご注意
- キットの中の試薬は、室温に戻してからご使用下さい。
- 輸送中の振動等により、内容物がチューブ壁面やキャップ裏面に付着している場合がありますので、内容物を底面に落とした後に開封して下さい。
- 正確な測定値を得るために、1つの測定試料につき複数 (n=3 以上) のウェルをご使用下さい。
- プレートリーダーは、測定前に37oCに設定して下さい。
- Mineral Oilや希釈したsample solutionは、ヒートブロックもしくは恒温槽で予め37oC付近に温めてご使用下さい。
- 測定試料は細胞数を数種類調製して下さい。
- 96穴マイクロプレートを用いる場合の細胞数は、浮遊細胞 (200,000 - 400,000 cells/well)、付着細胞 (30,000 - 50,000 cells/well) を推奨しております。
溶液調製
working solution の調製
- 血清を含む培地を使用して下さい。
- 表1を参考にOxygen Probe を培地で希釈する。
- 必要量のworking solution を調製する。
- working solution は光に不安定であるため使用直前に調製し、調製後はアルミホイルで覆うなどして遮光して下さい。
| 15 wells | 30 wells | 45 wells | 60 wells | 75 wells | 90 wells | |
| Oxygen Probe | 16.5 μl | 33 μl | 49.5 μl | 66 μl | 82.5 μl | 99 μl |
| 培地 | 1483.5 μl | 2967 μl | 4450.5 μl | 5934 μl | 7417.5 μl | 8901 μl |
操作
〈浮遊細胞〉
同一細胞種・細胞数においてsample の種類や濃度を検討する場合
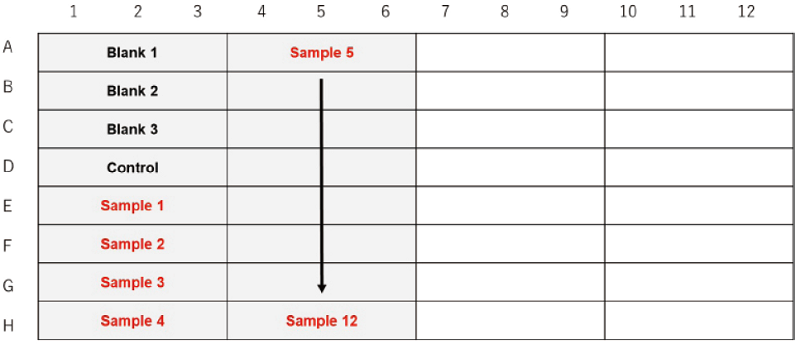
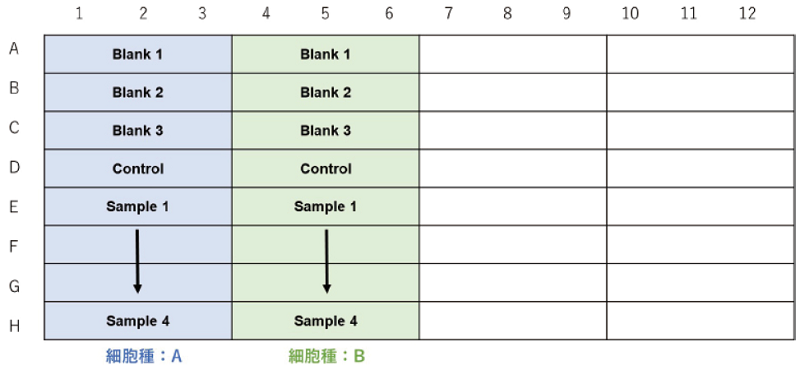
細胞種を検討する場合
細胞数を検討する場合
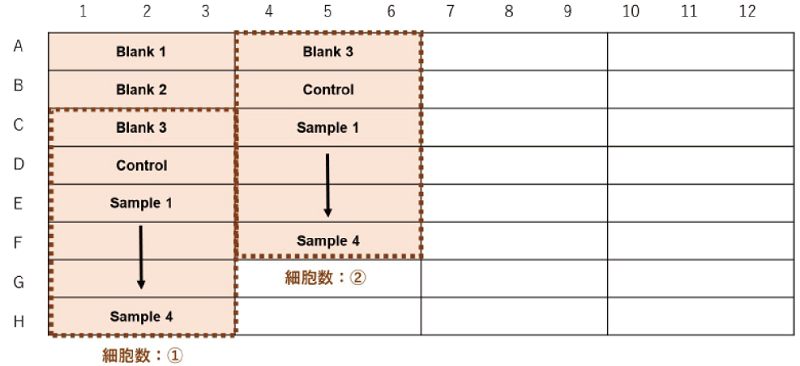
図2 プレートレイアウト例 (n=3)
| Blank 1 | Blank2 | Blank 3 | Control | Sample | |
| 培地 | 110 μl | 10 μl | 10 μl | 10 μl | - |
| working solution | - | 100 μl | - | - | - |
| 細胞 (培地に懸濁) | - | - | 100 μl | - | - |
| 細胞 (working solution に懸濁) | - | - | - | 100 μl | 100 μl |
| Sample solution | - | - | - | - | 10 μl |
| Mineral Oil | 1 滴 | 1 滴 | 1 滴 | 1 滴 | 1 滴 |
- 血清を含む培地を使用して下さい。
- 表2 を参考にBlank 3 として細胞(2.0-4.0×106 cells/ml) を培地に懸濁し、Control やSample として細胞(2.0-4.0×106 cells/ml) をworking solution に懸濁したものを用意し、図2 のレイアウト図を参考に、96 穴黒色クリアボトムマイクロプレートに100 μl (200,000-400,000 cells/well) ずつ播種する。
- 正確な測定値を得るために、1 つの測定試料につき複数(n=3 以上) のウェルをご使用下さい。
- 図2 のレイアウト図を参考に、Blank 1 には培地を100 μl 、Blank 2 にはworking solution を100 μl 添加する。
- 予め37 oC に設定しておいたプレートリーダーの中にマイクロプレートを入れ、30 分間インキュベーションする。
- インキュベーターではなく、プレートリーダーにてインキュベーションして下さい。
- Blank 1、Blank 2、Blank 3、Control に培地を10 μl ずつ添加する。
- 培地は37 oC 付近になるように、ヒートブロックや恒温槽で予め温めておいて下さい。
- Sample には、培地で希釈したsample solution を10 μl ずつ添加する。
- 希釈したsample solution は37 oC 付近になるように、ヒートブロックや恒温槽で予め温めておいて下さい。
- sample solution 添加後は、直ちにMineral Oil を1 滴ずつ各ウェルに滴下する。
- Mineral Oil は37 oC 付近になるように、ヒートブロックや恒温槽で予め温めておいて下さい。
- 37 oC に設定しておいたプレートリーダーの中にマイクロプレートを入れ、5 分間インキュベーションする。
- インキュベーターではなく、プレートリーダーにてインキュベーションして下さい。
- 蛍光マイクロプレートリーダーを用いて強度をタイムコースで10 分毎に200 分間測定する
(Ex: 500 nm, Em: 650 nm, Bottom リーディング)。 - ダウンロードした専用の計算シートに得られた強度の値を入力し、OCR 値を算出する。
〈付着細胞〉
同一細胞種・細胞数においてsample の種類や濃度を検討する場合
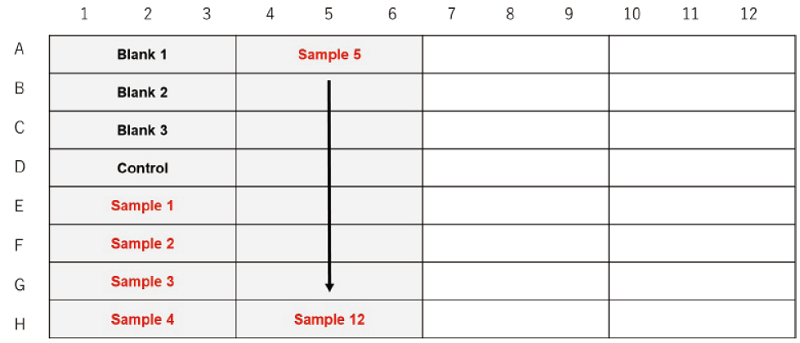
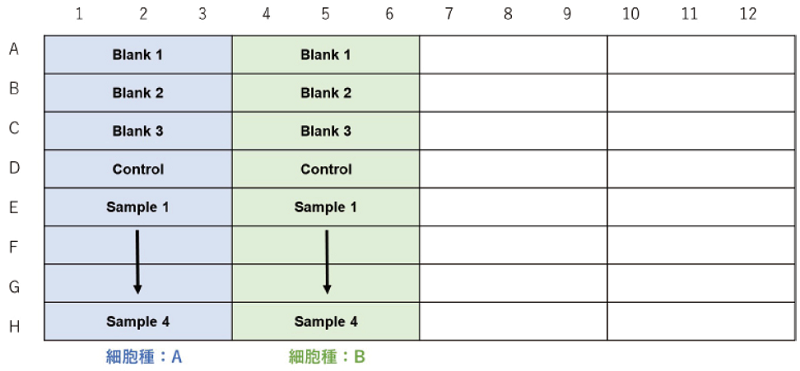
細胞種を検討する場合
細胞数を検討する場合
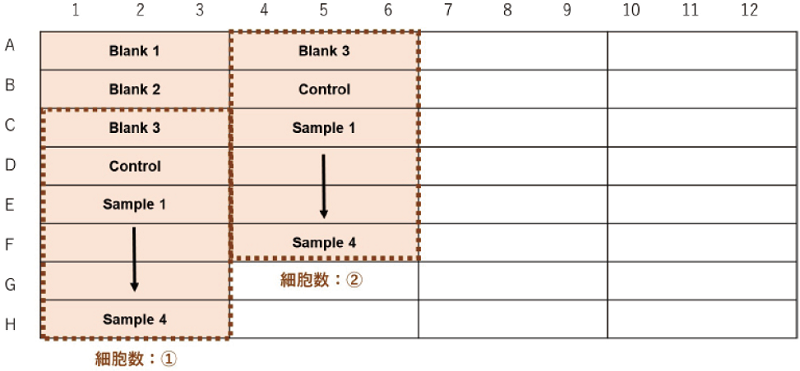
図3 プレートレイアウト例 (n=3)
| Blank 1 | Blank2 | Blank 3 | Control | Sample | |
| 培地 | 110 μl | 10 μl | 110 μl | 10 μl | - |
| working solution | - | 100 μl | - | 100 μl | 100 μl |
| Sample solution | - | - | - | - | 10 μl |
| Mineral Oil | 1 滴 | 1 滴 | 1 滴 | 1 滴 | 1 滴 |
- ※血清を含む培地を使用して下さい。
- 図3のレイアウト図を参考に、Blank 3、Control、Sample に細胞 (3.0-5.0 x 105 cells/ml) を100 μl (30,000-50,000 cells/well) ずつ96穴黒色クリアボトムマイクロプレートに播種する。
- 正確な測定値を得るために、1つの測定試料につき複数 (n=3 以上) のウェルをご使用下さい。
- OCR 測定後に核染色剤 (Hoechst 33342) によるウェル当たりの細胞数を算出する場合は、検量線作成用のウェルにも細胞播種して下さい。よくある質問に付着細胞での測定例がございますので、詳細はそちらをご覧下さい。
- インキュベーター (37oC、5%CO2 存在下) で一晩培養する。
- 細胞を剥がさないように注意しながら、ウェル中の培地を除去する。
- 図3 のレイアウト図を参考に、Blank 1、Blank 3 には培地を100 μl 、Blank 2、Control、Sampleにはworking solutionを100 μl 添加する。
- 予め37oC に設定しておいたプレートリーダーの中にマイクロプレートを入れ、30 分間インキュベーションする。
- インキュベーターではなく、プレートリーダーにてインキュベーションして下さい。
- Blank 1、Blank 2、Blank 3、Controlに培地を10 μlずつ添加する。
- 培地は37oC 付近になるように、ヒートブロックや恒温槽で予め温めておいて下さい。
- Sample には、培地で希釈したsample solutionを10 μlずつ添加する。
- 希釈したsample solution は37oC 付近になるように、ヒートブロックや恒温槽で予め温めておいて下さい。
- sample solution 添加後は、直ちにMineral Oil を1滴ずつ各ウェルに滴下する。
- Mineral Oil は37oC 付近になるように、ヒートブロックや恒温槽で予め温めておいて下さい。
- 37oCに設定しておいたプレートリーダーの中にマイクロプレートを入れ、5分間インキュベーションする。
- インキュベーターではなく、プレートリーダーにてインキュベーションして下さい。
- 蛍光マイクロプレートリーダーを用いて強度をタイムコースで 10 分毎に 200 分間測定する (Ex: 500 nm, Em: 650 nm, Bottom リーディング)。
- ダウンロードした専用の計算シートに得られた強度の値を入力し、OCR値を算出する。
解析
- 本計算シートは、取扱説明書に記載している操作手順 (ウェル条件や温度、液量) で測定を行った場合のみ適用できます。
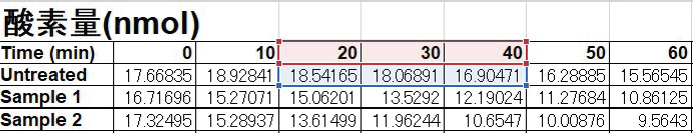
- 測定したデータの各時間におけるウェル条件ごとの強度の平均値を算出し、専用の計算シートの橙色の枠内に入力する (3-34 行目) 。

- 操作1. を入力すると、各条件における強度と酸素量 (nmol) の値が自動的に計算される。
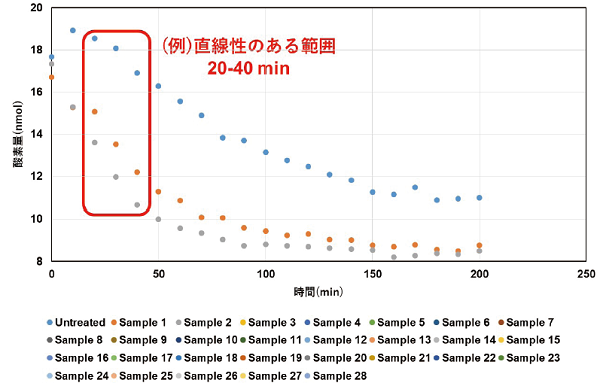
- グラフにおいて直線性の得られる範囲の酸素量 (nmol) と時間 (min) を選択し、ウェル当たりの酸素消費速度 (nmol/min) を算出する。
橙色の枠内に下記の計算式を入力
= -SLOPE (既知のy、既知のx)
(例) Untreated:「 = -SLOPE(D71:F71,D70:F70)」- 既知のy : 直線性の得られる酸素量 (nmol) の範囲
既知のx : 直線性の得られる時間 (min) の範囲
Sample 1:「= -SLOPE(D72:F72,D70:F70)」

- 既知のy : 直線性の得られる酸素量 (nmol) の範囲
- 操作3. を入力すると、ウェル当たりのOCR の単位をnmol/minからpmol/minへ変換した値が表に自動入力される。
- 細胞数で補正したOCRが必要な場合は、細胞数カウントや核酸量測定等を行って下さい。
実験例
HepG2細胞を用いたFCCP (脱共役剤) 処理によるOCRの変化
- HepG2細胞を5.0 x 105 cells/mlになるようにDMEM培地 (10% FBSを含む) で希釈し、96穴黒色クリアボトムマイクロプレートに100 μlずつ播種した。
- インキュベーター (37oC、5%CO2存在下) で一晩培養した。
- 細胞を剥がさないように注意しながら、ウェル中の培地を除去した。
- DMEM培地 (10% FBSを含む) とworking solution をそれぞれのウェルに100 μlずつ添加した。
- 予め37oC に設定したプレートリーダーの中にマイクロプレートを入れ、30分間インキュベートした。
- Blank 1、Blank 2、Blank 3、Control: DMEM培地 (10% FBS を含む)、Sample: DMEM培地 (10% FBSを含む) で希釈したFCCPを10 μlずつ各ウェルに添加した。
- 薬剤添加後、直ちにMineral Oilを1滴ずつ全てのウェルに滴下した。
- 37oC に設定したプレートリーダーの中にマイクロプレートを入れ、5 分間インキュベートした。
- 強度をタイムコースで10分毎に200分間測定した (Ex: 500 nm, Em: 650 nm, Bottomリーディング) 。
- 得られた強度の値を専用の計算シートに入力し、OCR値を算出した。
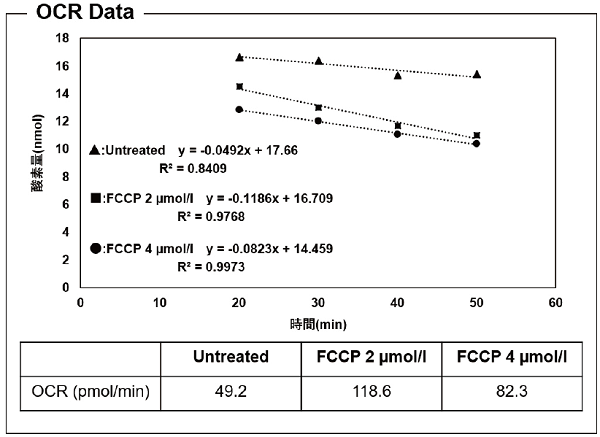
図4 FCCP (脱共役剤) によるOCR値の変化
FCCPを添加することによってOCR値は増加し、FCCPが高濃度になるとOCR値は減少することを確認した。
よくある質問/参考文献
E297: Extracellular OCR Plate Assay Kit
Revised Oct., 25, 2023


 を押して省略できます。
を押して省略できます。