はじめに
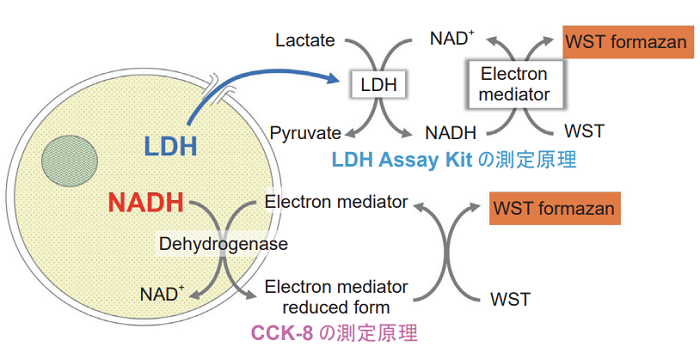
細胞毒性評価として、生存細胞数を指標とする方法または死細胞数を指標とする方法が汎用されています。近年、複数の指標を用いて評価することにより細胞毒性を総合的に判断するケースが増えてきています。Viability/Cytotoxicity Multiplex Assay Kitは、生存細胞数を指標とするCell Counting Kit-8 (CCK-8) と、死細胞数を指標とするCytotoxicity LDH Assay Kit-WST (LDH Assay Kit) を組合せたキットです。
CCK-8は生細胞内の脱水素酵素活性を、一方LDH Assay Kitは細胞膜の傷害により細胞外へ漏れ出てきた乳酸脱水素酵素 (LDH) を指標とすることで、前者は生存細胞数を後者は死細胞数を算出します。LDH Assay Kitは細胞培養液に直接試薬を加 えて測定するホモジニアスアッセイ、又は培養上清を用いて測定するノンホモジニアスアッセイが可能です。CCK-8とLDH Assay Kitのノンホモジニアスアッセイを組合せることで、同じ培養細胞を用いて二つの指標で細胞毒性評価を行うことができます。
キット内容
| コード | 容量 | コンポーネント | ||
| Cell Counting Kit-8 | CK04 | 500 tests | Cell Counting Kit-8 | 5 ml × 1 |
| Cytotoxicity LDH Assay Kit | CK12 | 500 tests | Dye Mixture | × 1 |
| Assay Buffer | 55 ml × 1 | |||
| Lysis Buffer | 5.5 ml × 1 | |||
| Stop Solution | 27.5 ml × 1 | |||
保存条件
0 ~ 5℃で保存してください。
必要なもの ( キット以外 )
- プレートリーダー (450 nm及び490 nmの吸光フィルター)
- CO2インキュベーター
- 20 μlおよび100 - 200 μl 8チャンネルピペット
- 細胞培養用96穴マイクロプレート
- LDH測定時、ホモジニアスアッセイでは付着細胞も浮遊細胞も平底プレートを使用しますが、浮遊細胞をノンホモジニアスアッセイで評価する場合は遠心操作が必要になるため、丸底または V 底プレートをご用意ください。
- 測定用 96 穴平底マイクロプレート(LDH Assay Kit のノンホモジニアスアッセイ時にのみ必要)
使用上のご注意
細胞種により最適条件が異なります。初めて測定を行う際は、予備実験に従い、最適条件 (細胞数、インキュベーション時間等) をご確認ください。
CCK-8を用いた生存細胞の評価
|
LDH Assay Kitを用いた死細胞の評価
|
・ホモジニアスアッセイ
|
・ノンホモジニアスアッセイ
|
同じ培養細胞を用いた生存細胞および死細胞の評価
- 実験例
段階希釈法
CCK-8 を用いた生存細胞の評価 CCK-8アッセイ
予備実験
予備実験では、最適な細胞数と発色反応時間を確認します。被験物質を添加しない状態の細胞(コントロール細胞)を使用してください。
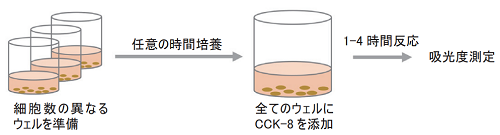
- 対数増殖期にある細胞の懸濁液5×105 cells/mlを準備する。
- 96ウェルマイクロプレート上で段階希釈法により細胞数の異なる細胞懸濁液 (100 μl) を調製する。
- CO2インキュベーター内で任意の時間培養する。
- CCK-8溶液を各ウェルに10 μlずつ添加する。
- 気泡は測定値のバラツキの原因となるので、 気泡を生じないよう添加する。
- CO2インキュベーター内で1 - 4時間呈色反応を行う。
- 発色量は細胞種や細胞数により異なります。CCK-8添加後は1時間毎に吸光度を測定し、下記の吸光度の目安を参考に必要な細胞数とインキュベーション時間を決定する。
細胞毒性評価時 : 1.0 - 1.5
細胞増殖評価時 : 0.3 - 0.8
- 発色量は細胞種や細胞数により異なります。CCK-8添加後は1時間毎に吸光度を測定し、下記の吸光度の目安を参考に必要な細胞数とインキュベーション時間を決定する。
- マイクロプレートリーダーにて吸光度を測定する。(フィルター : 450 - 490 nm)
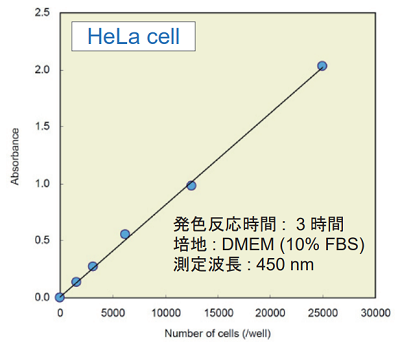
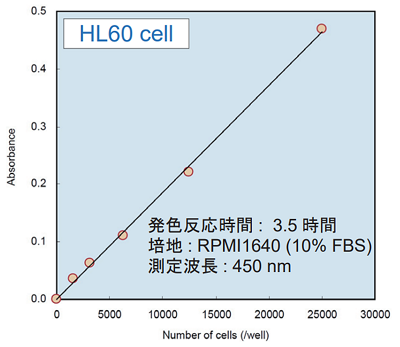
<実験例 : 細胞数毎の吸光度>
被験物質添加による 生存細胞評価
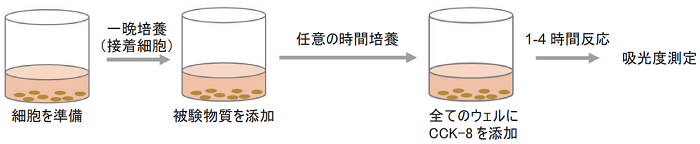
- 対数増殖期にある細胞を上記の予備実験で確認した細胞数となるよう細胞懸濁液を調製する。
- 96ウェルマイクロプレートの各ウェルに100 μlずつ播種し、CO2インキュベーター内で前培養する。
- 付着細胞の場合、細胞をプレートに接着させるため一晩培養する。
- 目的の濃度に調整した薬剤を各ウェルに10 μlずつ添加し、CO2インキュベーター内で一定時間 (6, 12, 24, 48時間) 培養する。
- 被験物質に着色または還元性がある場合には、 Blank として細胞を含まない培地に被験物質と CCK-8 を添加したウェルを準備する。
- CCK-8溶液を各ウェルに10 μlずつ添加する。
- 気泡は測定値のバラツキの原因となりますので、 気泡を生じないよう添加して下さい。
- CO2インキュベーター内で1 - 4時間呈色反応を行う。
- 発色量は細胞種や細胞数により異なります。上記の予備実験で確認した最適なインキュベーション時間で呈色反応を行ってください。
- マイクロプレートリーダーにて吸光度を測定する。(フィルター: 450 - 490 nm)
細胞生存率の算出式
細胞培養液に披検物質およびCCK-8を添加したSampleの吸光度と細胞培養液にCCK-8のみを添加したControlの吸光度から、細胞を含まないBlankの吸光度をそれぞれ引いた値 (3 重測定の平均値) を用いて算出する。

| Control | : 細胞を含む培地に CCK-8 を添加したウェル |
| Blank | : 細胞を含まない培地に CCK-8 を添加したウェル |
| Sample | : 細胞を含む培地に被験物質、 CCK-8 を添加したウェル |
LDH Assay Kitを用いた死細胞の評価 LDH Assay Kit アッセイ
本キットは2つの測定法に対応しているため、実験状況に応じて測定方法を選択することができる。
-
ホモジニアスアッセイ
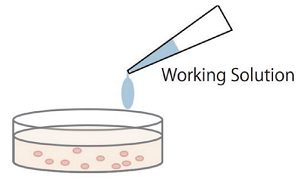
細胞培養液の入った各ウェルに直接Working Solutionを添加し、発色反応を行う。培養上清を移し変える操作もなく簡単な操作で測定ができる。
-
ノンホモジニアスアッセイ
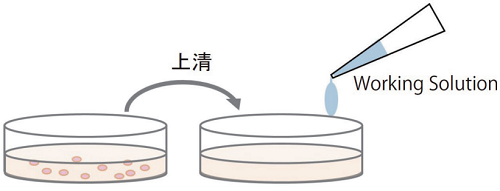
細胞培養液の上清を他のプレートに移し測定するため、アッセイで使用した細胞(高コントロールを除く)はCCK-8を用いた生存細胞の試験や細胞染色など他の実験に使用できる。
Working Solutionの調製
- Dye Mixtureに適量のAssay Bufferを加えて、転倒混和により内容物を完全に溶解する。
- 5mlのAssay BufferをDye Mixtureに加えると完全に溶解します。
- 1.で調製した溶液全量をAssay Bufferのボトルに移して、転倒混和により混合する。
- Working Solution調製後は遮光下、0 ~ 5 ℃で保存してください (6 ヶ月間安定 )。
ホモジニアスアッセイ
予備実験
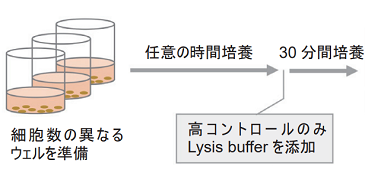
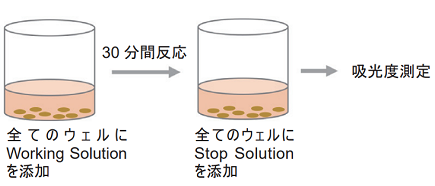
-
- 対数増殖期にある細胞の懸濁液5×105 cells/mlを準備する。
- 段階希釈法により細胞数の異なる細胞懸濁液を調製し、図1のプレート配置を参考に高コントロール及び低コントロー ルのウェルに細胞懸濁液および培地を各50 μl、バックグラウンドコントロールのウェルには培地のみを100 μl添加する。
- CO2インキュベーター内で任意の時間培養する。
- 高コントロール用のウェルにLysis Buffer 10 μlを加える。
- CO2インキュベーター内で30分間インキュベーションする。
- 全てのウェルにWorking Solution 100 μlを加える。遮光下、室温で30分間呈色反応を行う。
- 全てのウェルにStop Solution 50 μlを加える。
- プレートリーダーを用いて490 nmの吸光度を測定する。
- 得られた吸光度を縦軸に、細胞数を横軸にプロットし、下記の点を考慮し最適な細胞数を決定することをお勧めします。
細胞数と吸光度でプロットし直線性があり、吸光度が 2.0 以下の細胞数を選択する。
高コントロールと低コントロールの吸光度差が 0.2 以上となる細胞数を選択する。
- 得られた吸光度を縦軸に、細胞数を横軸にプロットし、下記の点を考慮し最適な細胞数を決定することをお勧めします。
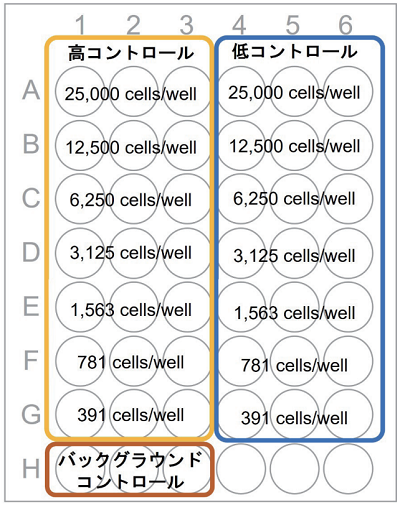
図 1 プレート配置図
| 実験サンプル | 高コントロール | 低コントロール | バックグラウンドコントロール | |
| 培地 | - | 50 μl | 50 μl | 100 μl |
| 細胞懸濁液 | 50 μl | 50 μl | 50 μl | - |
| 被験物質 | 50 μl | - | - | - |
| Lysis Buffer | - | 10 μl | - | - |
- 実験サンプルと高コントロールの液量の違いは測定結果に影響を与えません。
| 実験サンプル | : 被験物質を細胞に加えたことにより傷害をうけた細胞から放出されるLDHの活性 |
| 高コントロール | : 細胞中の全LDH活性(放出される LDH の活性の最大値) |
| 低コントロール | : 薬剤処理していない細胞から自然に放出されるLDHの活性 |
| バックグラウンドコントロール | : 培地中に含まれるLDHの活性 |
細胞毒性試験
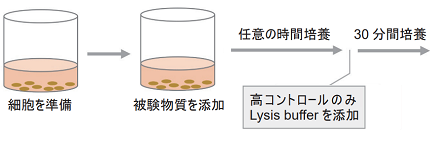
- 平底96穴マイクロプレートに培地で調製した細胞懸濁液50 μlを加える。
- 付着細胞の場合、細胞を一晩インキュベーションして、新しい培地50 μlに交換した後に操作2.へ進む。
- 培地で目的の濃度に調製した被験物質溶液50 μlを 操作1. の細胞懸濁液に加える(表 1)。
- 37℃で適切な時間CO2インキュベーター内でインキュベーションする。
- 高コントロールウェルにLysis Buffer 10 μlを加え、37℃、30分間CO2インキュベーター内でインキュベーションする。
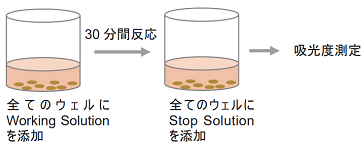
- 各ウェルにWorking Solution 100 μlを加える。遮光下、室温で30分間呈色反応を行う。
- 全てのウェルにStop Solution 50 μlを加える。
- プレートリーダーを用いて490 nmの吸光度を測定する。
細胞毒性の算出式
被験物質および各コントロールの吸光度からバックグランドコントロールの吸光度を引いた値 (3 重測定の平均値) を用いて算出する。
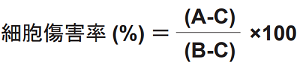 |
A: 被験物質 B: 高コントロール C: 低コントロール |
ノンホモジニアスアッセイ
予備実験
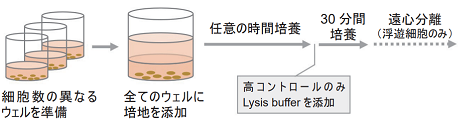
-
- 対数増殖期にある細胞を培地で洗浄し、培地を用いて5×105 cells/mlの細胞懸濁液を準備する。
- 96ウェルマイクロプレートの各ウェルに、段階希釈法により調製した細胞懸濁液を100 μlずつ入れる。併せて高コントロール、低コントロール及びバックグランドコントロール (培地のみ) を各々3ウェルずつ準備する。(図 2)
- 培地100 μlを全てのウェルに加える。
- 37℃のCO2インキュベーターでインキュベーションする。
- 高コントロール用のウェルにLysis Buffer 20 μlを加える。
- 37℃、30分間CO2インキュベーター内でインキュベーションする。
- 250 × g、2分間、マイクロプレートを遠心する。(浮遊細胞の場合)
- 各ウェルから上清100 μlを注意深く取り、測定用96穴マイクロプレートに移す。
- 全てのウェルにWorking Solution 100 μlを加える。遮光下、室温で30分間呈色反応を行う。
- 全てのウェルにStop Solution 50 μlを加える。
- プレートリーダーを用いて490 nmの吸光度を測定する。
- 得られた吸光度を縦軸に、細胞数を横軸にプロットし、下記の点を考慮し最適な細胞数を決定することをお勧めします。
細胞数と吸光度でプロットし直線性があり、吸光度が2.0以下の細胞数を選択する。
高コントロールと低コントロールの吸光度差が0.2以上となる細胞数を選択する。
- 得られた吸光度を縦軸に、細胞数を横軸にプロットし、下記の点を考慮し最適な細胞数を決定することをお勧めします。
-

図 2 プレート配置図
細胞毒性試験
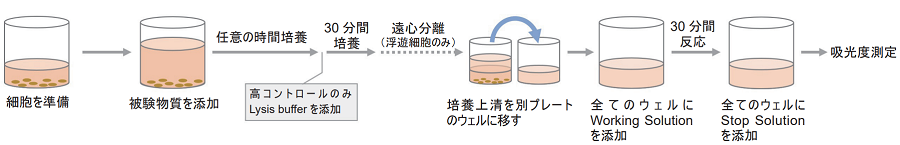
- 96 穴マイクロプレートに培地で調製した細胞懸濁液100 μlを加える。
- 付着細胞の場合、細胞を一晩インキュベーションして、新しい培地100 μlに交換した後に操作2)へ進む。
- 培地で目的の濃度に調製した被験物質溶液100 μlを1)の細胞懸濁液に加える(表 2)。
- 37℃のCO2インキュベーターで適切な時間インキュベーションする。
- 高コントロールウェルにLysis Buffer 20 μlを加え、37℃、30分間CO2インキュベーター内でインキュベーションする。
- 250 × g、2分間、マイクロプレートを遠心する。(浮遊細胞の場合)
- 各ウェルから上清100 μlを注意深く取り、測定用96穴マイクロプレートに移す。
- 全てのウェルにWorking Solution 100 μlを加える。遮光下、室温で30分間呈色反応を行う。
- 全てのウェルにStop Solution 50 μlを加える。
- プレートリーダーを用いて490 nmの吸光度を測定する。
細胞毒性の算出式
被験物質と各コントロールの吸光度からバックグランドコントロールの吸光度を引いた値 (3 重測定の平均値) を用いて算出する。
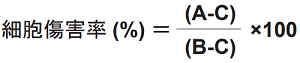 |
A: 被験物質 B: 高コントロール C: 低コントロール |
| 実験サンプル | 高コントロール | 低コントロール | バックグラウンドコントロール | |
| 培地 | 20 μl | 100 μl | 120 μl | 220 μl |
| 細胞懸濁液 | 100 μl | 100 μl | 100 μl | - |
| 被験物質 | 100 μl | - | - | - |
| Lysis Buffer | - | 20 μl | - | - |
| 実験サンプル | : 被験物質を細胞に加えたことにより傷害をうけた細胞から放出されるLDHの活性 |
| 高コントロール | : 細胞中の全LDH活性(放出されるLDHの活性の最大値) |
| 低コントロール | : 薬剤処理していない細胞から自然に放出されるLDHの活性 |
| バックグラウンドコントロール | : 培地中に含まれるLDHの活性 |
同じ培養細胞を用いた生存細胞および死細胞の評価
同じ細胞を用いたCCK-8及びLDH Assay Kitによる実験例
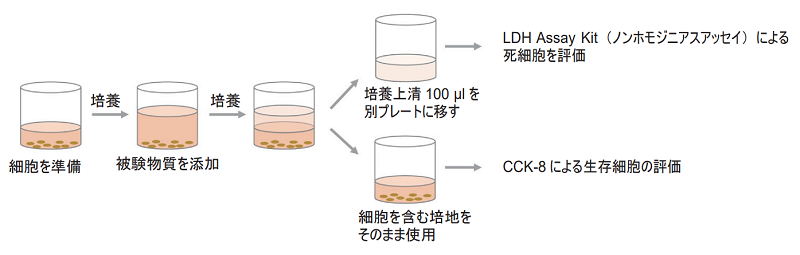
- HeLa 細胞(ヒト子宮頸癌細胞)5000 cells/100 µlを96ウェルプレートに播種する。
- CO2インキュベーター (37℃) で1晩インキュベーションする。
- 被験物質100 µlを添加する。
- CO2インキュベーター (37℃) で1時間インキュベーションする。
- 被験物質の薬剤暴露時間となるので、インキュベーション時間は実験によって適切な時間行う。
- インキュベーション終了30分前に、LDHアッセイ用の高コントロールのウェルにLysis buffer 20 µlを添加する。
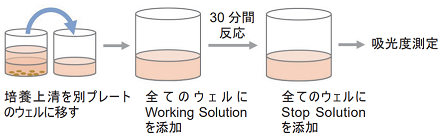
培養上清を用いたLDHアッセイ(ノンホモジニアスアッセイ法に基づき操作)
- 培養上清100 µlを別のプレートヘ添加する。
- 各ウェルにWorking Solution 100 µlを添加する。
- 遮光下、室温で30分間呈色反応する。
- 全てのウェルにStop Solution 50 µlを添加する。
- プレートリーダーを用いて490 nmの吸光度を測定する。
細胞を含む培地を用いた CCK-8 アッセイ
- 上清100 µlを除いた細胞を含む培地100 µlにCCK-8を10 µl添加する。
- CO2インキュベーター (37℃) で3時間呈色反応する。
- 呈色反応時間は、 予備実験の項を参考に最適な発色時間を確認する。
- プレートリーダーを用いて450 nmの吸光度を測定する。
| Tween 20 を用いた細胞毒性試験 | |
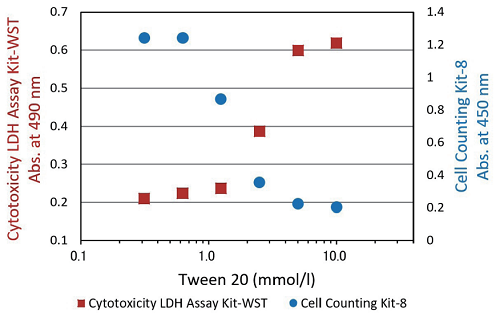 |
細胞 : HeLa 細胞 培地 : MEM、 10% FBS 被験物質 : Tween 20 薬剤暴露時間 : 1 時間 |
| 図3 細胞毒性試験 | |
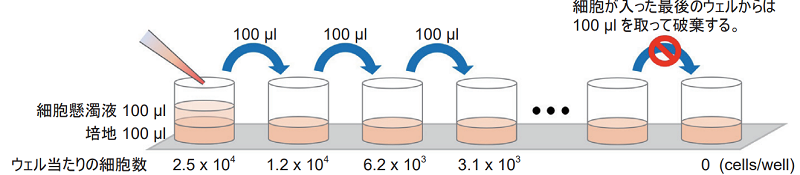
段階希釈法
8チャンネルマルチピペットを用いて、96ウェルマイクロプレートの各ウェルに培地100 μlを入れて、次に5 × 105 cells/mlに調製した細胞懸濁液100 μlを細胞数が最大となるウェルに加えてピペッティングする。その後、細胞濃度が半分となった細胞懸濁液100 μlを次のウェルに移して、同様にピペッティングにて混合する。以降、この操作を繰り返す。
段階希釈の操作模式図
よくある質問/参考文献
CK17: Viability/Cytotoxicity Multiplex Assay Kit
Revised Aug., 24, 2023


 を押して省略できます。
を押して省略できます。

