はじめに
免疫研究分野では、免疫細胞を解析するためにフローサイトメーターがよく使用されています。免疫細胞は、特徴的な表面抗原をもち、これらの表面マーカー特異的な蛍光標識抗体を利用して免疫染色を行うことにより、フローサイトメーターでの解析が可能となります。この場合、解析対象に死細胞が含まれると抗体の非特異的な結合を引き起こし、解析の信頼性が低下する原因となります。そこで、データの質を向上させるために死細胞を染色し死細胞を解析から除くことが重要です。
死細胞を染色する色素として、Propidium Iodide (PI) が広く使用されています。しかし、PIを使って死細胞を染色する場合、細胞の固定化・膜透過処理による色素の細胞からの漏れ出しが知られています。これにより、遊離したPIが、固定・膜透過処理された生細胞を染色するため、偽陽性の結果をもたらす可能性があります。
Dead Cell Makeup Dyesは、細胞膜非透過性のため生細胞には入り込まず、死細胞の損傷した膜を通って入り込み、細胞内のタンパク質と安定な共有結合を形成します。そのため、細胞の固定・膜透過処理によって細胞膜の完全性が損なわれても、細胞から色素が漏れ出すことはありません (図1) 。さらに、本色素で染色された生細胞と死細胞の蛍光強度差は大きく(図2)、フローサイトメトリーにおいて容易に死細胞を区別し除去することが可能です。
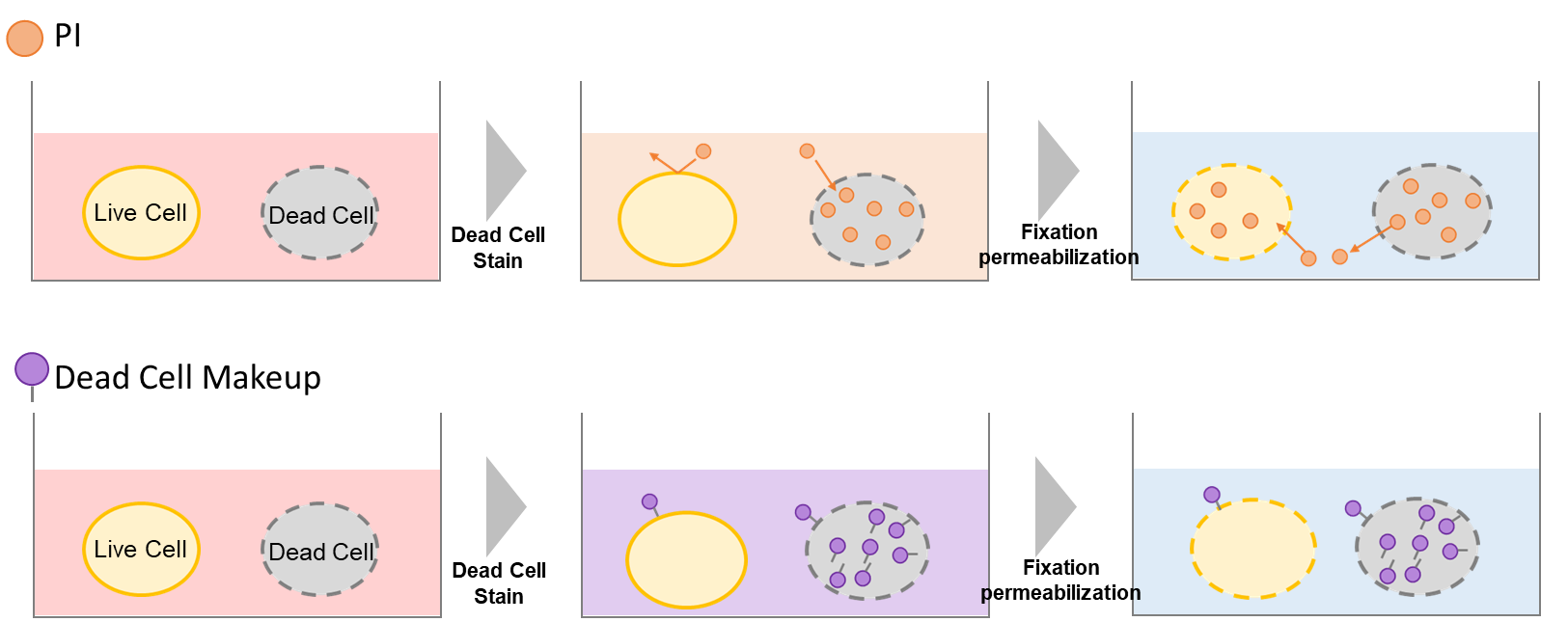
図1 PIとDead Cell Makeup Dyesの染色原理
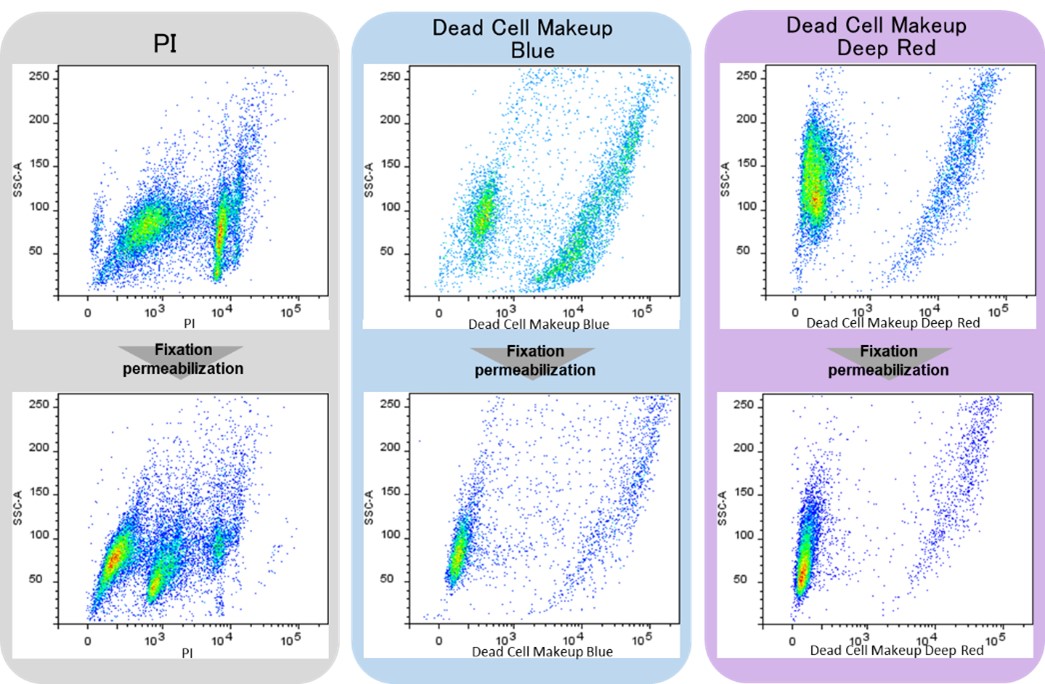
図2 PIとDead Cell Makeup Dyesを用いたフローサイトメーターでの解析
内容
| C555 : | Dead Cell Makeup Blue | x1 |
| C556 : | Dead Cell Makeup Deep Red | x1 |
- Dead Cell Makeup Blueはチューブに無色フィルム状で付着しており、目視では確認しづらい場合があります。取扱いにご注意下さい。
保存条件
C555 : 遮光、0–5 °Cにて保存してください。
C556 : 遮光、-20°Cにて保存してください。
必要なもの (キット以外)
- フローサイトメーター
- セルストレーナー
- マイクロピペット
- マイクロチューブ
- 遠心機
- Dimethylsulfoxide (DMSO)
- Phosphate-buffered saline (PBS)
溶液調製
Dead Cell Makeup Dye DMSO stock solutionの調製
Dead Cell Makeup DyeにDMSO 50 µlを加え、ボルテックス及びピペッティングで溶解する。
- 調製後は、遮光下-20℃で保存してください。調製後は6ヶ月保存できることを確認しております。
- 6ヶ月以上の長期保存をされる場合、未開封のDMSO をご使用ください。また必要に応じて小分けし、-20℃で保存してください。
Dead Cell Makeup Dye working solutionの調製
Dead Cell Makeup Dye DMSO stock solutionをPBSで1,000倍希釈し、Dead Cell Makeup Dye working solutionを調製する。
- Dead Cell Makeup Dye working solutionは保存できません。調製したその日のうちにご使用ください。
操作
- 細胞密度1–10 x 106 cells/ml の細胞懸濁液を準備する。
- 付着細胞の場合は、スクレーパー又はトリプシン処理により細胞をはがして、細胞懸濁液をご準備ください。
- 細胞懸濁液を1.5 ml チューブに1 ml 入れ、300 x g で5分間遠心する。
- 上澄みを除去し、Dead Cell Makeup Dye working solution 500 μl を添加し、ピペッティングにより懸濁する。
- 遮光下、室温で15分間静置し、300 x g で5分間遠心する。
- 上澄みを除去し、PBS 300 μl を添加し、ピペッティングにより懸濁する。
- 300 x g で5分間遠心する。
- 上澄みを除去し、PBS 300 μl を添加し、ピペッティングにより懸濁する。
- サンプルをフローサイトメーター測定用のセルストレーナーに通す。
- フローサイトメーターで測定する。
- 細胞の固定化、膜透過処理を行う場合は、操作7の後に行って下さい。
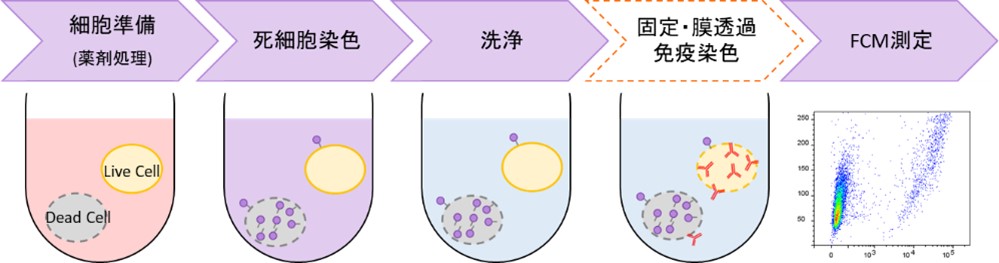
| コード | 製品名 | 励起波長 | 蛍光波長 |
| C555 | Dead Cell Makeup Blue | 405 nm |
450 / 50 nm Ex.) Pacific Blue・Alexa Fluor 405・Brilliand Violet 421 |
| C556 | Dead Cell Makeup Deep Red | 640 nm |
670 / 30 nm Ex.) APC・Alexa Fluor 647・Cy5 |
実験例
浮遊細胞:MOLT-4細胞の疲弊誘導後のPD-1検出
- 細胞密度 5 x 106 cells/ml の細胞懸濁液を準備した。
- 上澄みを除去し、500 ng/ml Ionomycinと50 ng/ml PMA (Phorbol 12-myristate 13-acetate) を含むRPMI培地で、37℃で 48時間インキュベートした。
- 細胞懸濁液を1.5 ml チューブに1 ml 入れ、300 x g で5分間遠心した。
- 上澄みを除去し、Dead Cell Makeup Dye working solution 500 μl を添加し、ピペッティングにより懸濁した。
- 遮光下、室温で15分間静置し、300 x g で5分間遠心した。
- 上澄みを除去し、PBS 300 μl を添加し、ピペッティングにより懸濁した。
- 300 x g で5分間遠心した。
- 4% PFA (PBS) 100 μl を添加し、ピペッティングにより懸濁した。
- 室温で30分間静置し、1,000 x g で5分間遠心した。
- 上澄みを除去し、0.1% Triton X-100 (PBS) 100 μl を添加し、ピペッティングにより懸濁した。
- 室温で30分間静置し、1,000 x g で5分間遠心した。
- 上澄みを除去し、10% Blocking One-P (PBS) 300 μl を添加し、ピペッティングにより懸濁した。
- 室温で30分間静置し、1,000 x g で5分間遠心した。
- 上澄みを除去し、Anti-PD1 antibody (Mouse) / 10% Blocking One-P (PBS) 300 μl を添加し、ピペッティングにより懸濁した。
- 室温で1時間静置し、1,000 x g で5分間遠心した。
- 上澄みを除去し、10% Blocking One-P (PBS) 300 μl を添加し、ピペッティングにより懸濁した。
- 1,000 x g で5分間遠心した。
- Alexa FluorTM 488 Anti-Mouse antibody 10% Blocking One-P (PBS) 500 μl を添加し、ピペッティングにより懸濁した。
- 室温で1時間静置し、1,000 x g で5分間遠心した。
- 上澄みを除去し、10% Blocking One-P (PBS) 300 μl を添加し、ピペッティングにより懸濁した。
- 1,000 x g で5分間遠心した。
- 上澄みを除去し、10% Blocking One-P (PBS) 300 μl を添加した。
- サンプルをフローサイトメーター測定用のセルストレーナーに通した。
- フローサイトメーター (機種: Becton Dickinson社 LSR-Fortessa X-20) で測定した。
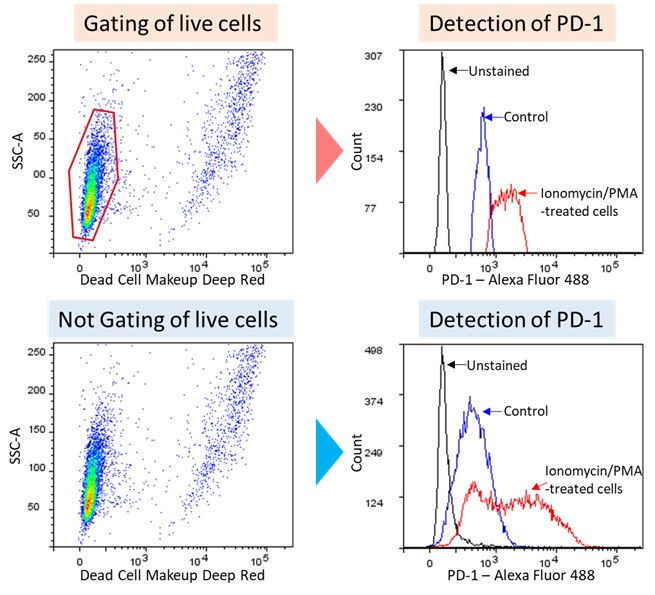
図3 MOLT-4の疲弊誘導時のPD-1検出
よくある質問/参考文献
C555_C556: Dead Cell Makeup Blue/Deep Red - Higher Retention than PI
Revised Aug., 30, 2023


 を押して省略できます。
を押して省略できます。




