はじめに
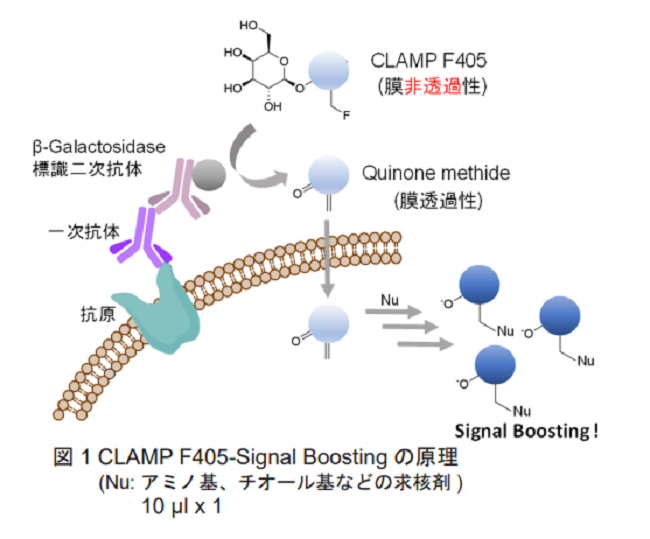
近年、細胞表面抗原を標的としたがん治療や診断が注目され、がんの早期発見や治療等のためにがん細胞や免疫 細胞などの細胞表面抗原の研究が活発化しています。しかしながら、細胞表面タンパク質には発現量が少ないもの も多く、従来技術では検出及び解析が困難な場合が多く見られます。 細胞表面タンパク質の特異的な検出方法として、蛍光標識抗体を用いた蛍光検出法が広く知られています(蛍光 免疫染色法)。しかし、感度が低く、適用対象が限られるという問題が存在しております。 そこで、今回我々はこれらの課題を解決するために、高感度蛍光染色法 CLAMP 法(quinone methide-based catalyzed signal amplification)を開発しました(図 1)。本手法では、抗原を一次抗体と β-Galactosidase(β-Gal) 標識抗体で標識した後、β-Gal の蛍光基質である CLAMP F405 を用いて蛍光染色を行います。CLAMP F405 自体は 無蛍光で細胞膜非透過性の化合物ですが、β-Gal と反応すると、細胞膜透過性の quinone methide へ変換され、細胞 内のアミノ基やチオール基などの求核剤と反応して蛍光を発します。この蛍光シグナルは β-Gal による酵素反応に よって増幅されるため、特定の細胞表面タンパク質を発現する細胞を選択的かつ高感度に蛍光染色することが可能 です。また、生細胞の細胞表面タンパク質だけでなく、固定細胞や組織切片の様々な抗原検出にも適用可能です。
内容
CLAMP F405-Signal Boosting 10 µl x 1
保存条件
-20℃にて保存してください。
必要なもの
- 一次抗体に対応した Isotype Control
- β-Galactosidase 標識二次抗体
- CO2 インキュベーター (37℃ )
- マイクロピペット - 1.5 ml マイクロチューブ
- Hanks’ Balanced Salt Solution (HBSS)
- Phosphate buffered saline (PBS)
- Paraformaldehyde (PFA) 溶液
- Blocking Buffer: 固定細胞・組織を用いる場合のブロッキング溶液 (実績:1% BSA/PBS, 10% Blocking One (03953-95: ナカライテスク社 )/PBS)
- Dimethyl sulfoxide (DMSO: 浮遊細胞の染色液調製用)
- チューブローテーター(浮遊細胞の染色用、実績:RVM-101、サイニクス社)
使用上のご注意
・輸送中の振動等により、内容物がチューブ壁面やキャップ裏面に付着している場合が ありますので、遠心してからご使用ください。
溶液調製
Staining Solution の調製
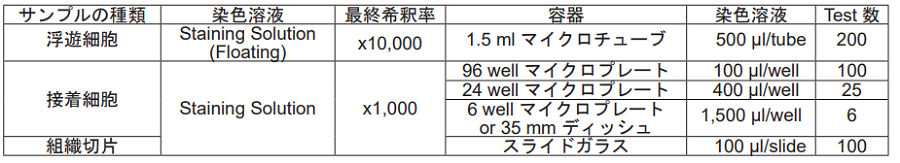
サンプルの種類により溶液の希釈率が異なります。下記に従い、溶液の調製を行ってください。
- 浮遊細胞 -
CLAMP F405-Signal Boosting を新しい 1.5 ml マイクロチューブにとり、DMSO で 10 倍希釈する。この溶液 を HBSS(生細胞)または PBS(固定細胞)で 1,000 倍希釈し、Staining Solution(Floating)とする。
※ DMSO で 10 倍希釈した CLAMP F405-Signal Boosting は調製後 -20℃で 2 週間安定です。
※ Staining Solution (Floating) は保存できません。調製したその日のうちにご使用下さい。
- 接着細胞、組織切片 -
CLAMP F405-Signal Boosting を HBSS(生細胞)または PBS(固定細胞または組織切片)で 1,000 倍希釈し、 Staining Solution とする。
※ Staining Solution は保存できません。調製したその日のうちにご使用下さい。
プロトコルの選択
サンプルの種類によってプロトコルを選択してください。また、本技術は高感度であるために、一般的な二次抗体 法で用いる抗体濃度では抗体等の非特異的吸着によるバックグラウンドが高くなります。そのため、選択したプロ トコルでのサンプルに適した抗体濃度を設定するための [ 抗体濃度の検討 ](下記)を行ってください。
抗体濃度の検討
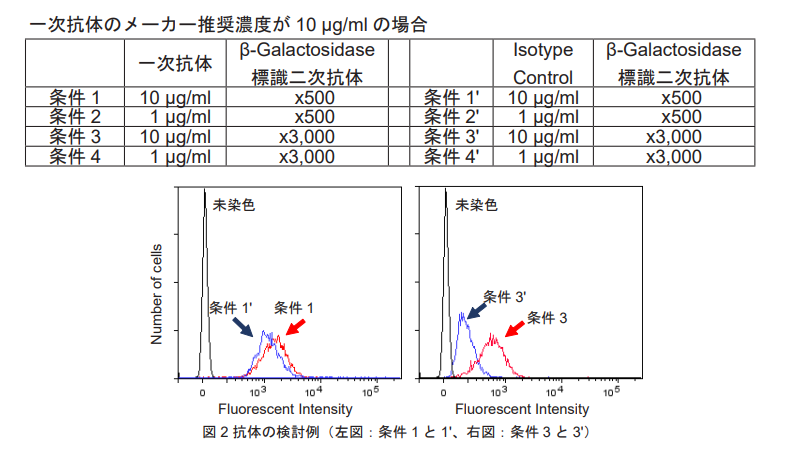
下表の 8 条件をすべて行い、Isotype Control ( 条件 1' - 4') の蛍光強度が十分に低く、対応する条件 1 - 4 の蛍光強度 との比が高いものを選択してください。( 図 2 の場合は条件 3 と 3' を選択します。)
・一次抗体はメーカー推奨の濃度以下をご検討ください。
・β-Galactosidase 標識二次抗体は 500 - 10,000 倍希釈液をご検討ください。
プロトコル1
生細胞・接着細胞用
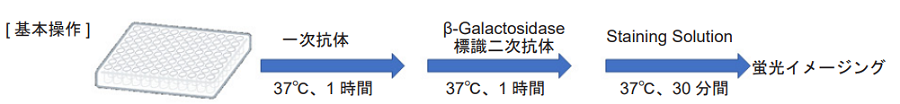 1. 細胞を 96-well マイクロプレートに播種し、5% CO2 インキュベーター(37℃)内で一晩培養する。
1. 細胞を 96-well マイクロプレートに播種し、5% CO2 インキュベーター(37℃)内で一晩培養する。
2. 上清を除去した後、培地 100 μl で 2 回洗浄する。
3. 一次抗体※ / 培養培地 100 μl を添加し、 5% CO2 インキュベーター(37℃)内で 1 時間静置する。
4. 上清を除去した後、培地 100 μl で 2 回洗浄する。
5. β-Galactosidase 標識二次抗体 ※/ 培地 100 μl を添加し、 5% CO2 インキュベーター(37℃)内で 1 時間静置する。
6. 上清を除去した後、HBSS 100 μl で 2 回洗浄する。
7. Staining Solution 100 μl を添加し、 5% CO2 インキュベーター(37℃)内で 30 分間静置する。
8. 上清を除去した後、HBSS 100 μl で 3 回洗浄する。
9. 蛍光顕微鏡で観察する。
※ [ 抗体濃度の検討 ] に従って、適切な抗体濃度の検討を行ってください。
プロトコル2
生細胞・浮遊細胞用
 1. 1.5 ml マイクロチューブに 2 x 105 cells/tube になるように細胞を分注する。
1. 1.5 ml マイクロチューブに 2 x 105 cells/tube になるように細胞を分注する。
2. 300 x g, 5 分間遠心し、上清を除去する。
3. 一次抗体※ / 培地 500 μl を添加し、ピペッティングにより懸濁する。
4. 37℃で 1 時間静置する。
5. 下記洗浄工程を行う。
I. 300 x g で 5 分間遠心し、上清を除去する。
II. 培地 500 μl を添加し、ピペッティングにより懸濁する。
III. 300 x g で 5 分間遠心し、上清を除去する。
IV. ステップ II - III をもう一度行う。
6. β-Galactosidase 標識二次抗体 ※/ 培地 500 μl を添加し、ピペッティングにより懸濁する。
7. 37℃で 1 時間静置する。
8. 操作 5 と同じ洗浄工程を行う。(培地を HBSS に変更する。)
9. HBSS で調製した Staining Solution (Floating) 500 μl を添加し、ピペッティングにより懸濁する。
10. 37℃、30 分間チューブローテーターで攪拌する。
Note: 攪拌せずに静置して染色を行うと、十分な感度が得られません。
11. 300 x g で 5 分間遠心し、上清を除去する。
12. HBSS 500 μl を添加し、ピペッティングにより懸濁する。
13. フローサイトメーターで測定する。
※ [ 抗体濃度の検討 ] に従って、適切な抗体濃度の検討を行ってください。
プロトコル3
固定細胞・接着細胞用

PFA 固定細胞の準備
1. 細胞を 96-well マイクロプレートに播種し、5% CO2 インキュベーター(37℃)内で一晩培養する。
2. 上清を除去した後、PBS 100 μl で 2 回洗浄する。
3. 4% PFA/PBS 100 μl を添加し、室温で 30 分間静置する。
4. 上清を除去した後、0.1% TritonX-100/PBS 100 μl を添加し、室温で 30 分間静置する。
Note: 細胞表面抗原のみを検出対象とする場合には操作4を省略してください。
5. 上清を除去した後、Blocking Buffer 100 μl/well を添加し、室温で 30 分間静置する。
染色工程
1. 上清を除去した後、一次抗体※ /Blocking Buffer 100 μl を添加し、室温で 1 時間静置する。
2. 上清を除去した後、Blocking Buffer 100 μl で 2 回洗浄する。
3. β-Galactosidase 標識二次抗体 ※/Blocking Buffer 100 μl を添加し , 室温で 1 時間静置する。
4. 上清を除去した後、Blocking Buffer 100 μl で 2 回洗浄する。
5. Staining Solution 100 μl を添加し、37℃で 30 分間静置する。
6. 上清を除去した後、PBS 100 μl で 3 回洗浄する。
7. 蛍光顕微鏡で観察する。
※ [ 抗体濃度の検討 ] に従って、適切な抗体濃度の検討を行ってください。
プロトコル4
固定細胞・浮遊細胞用
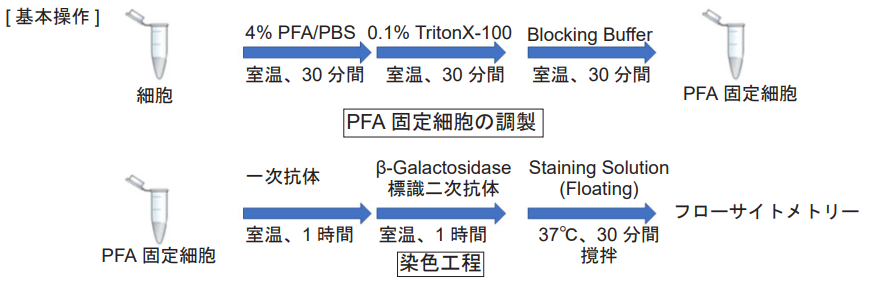
PFA 固定細胞の準備
1. 1.5 ml マイクロチューブに細胞懸濁液(2-10 x 105 cells/tube)を準備する。
2. 300 x g で 5 分間遠心し、上清を除去する。
3. 4% PFA/PBS 500 μl を添加し、ピペッティングにより懸濁する。
4. 室温で 30 分間静置し、300 x g で 5 分間遠心する。
5. 上清を除去した後、0.1% TritonX-100/PBS 500 μl を添加し、ピペッティングにより懸濁する。
6. 室温で 30 分間静置し、300 x g で 5 分間遠心する。
Note: 細胞表面抗原のみを検出対象とする場合には操作 5 と 6 を省略してください。
7. 上清を除去した後、Blocking Buffer 500 μl を添加し、ピペッティングにより懸濁する。
8. 室温で 30 分間静置し、300 x g で 5 分間遠心した後、上清を除去し、染色工程に使用する。
Note: 保存する場合は、Blocking Buffer 500 μl を添加し、ピペッティングにより懸濁した後、冷蔵保存する。
染色工程
1. 一次抗体※ /Blocking Buffer 500 μl を添加し、ピペッティングにより懸濁する。
Note: 保存サンプルを用いる場合は、300 x g で 5 分間遠心し、上清を除去した後、使用する。
2. 室温で 1 時間静置する。
3. 下記洗浄工程を行う。
I. 300 x g で 5 分間遠心し、上清を除去する。
II. Blocking Buffer 500 μl を添加し、ピペッティングにより懸濁する。
III. 300 x g で 5 分間遠心し、上清を除去する。
IV. ステップ II - III をもう一度行う。
4. β-Galactosidase 標識二次抗体 ※/Blocking Buffer 500 μl を添加し、ピペッティングにより懸濁する。
5. 室温で 1 時間静置する。
6. 操作 3 と同じ洗浄工程を行う。
7. PBS で調製した Staining Solution (Floating) 500 μl を添加し、ピペッティングにより懸濁する。
8. 37℃で 30 分間チューブローテーターで攪拌する。
Note: 攪拌せずに静置して染色を行うと、十分な感度が得られません。
9. 300 x g で 5 分間遠心し、上清を除去する。
10. Blocking Buffer 500 μl を添加し、ピペッティングにより懸濁する。
11. フローサイトメーターで測定する。
※ [ 抗体濃度の検討 ] に従って、適切な抗体濃度の検討を行ってください。
プロトコル5
凍結組織切片用
PFA 固定
1. 凍結組織切片 / スライドガラスを常温に戻す。
2. 組織切片の周囲に撥水ペンを用いて境界を描く。
3. 4% PFA/PBS 100 μl を添加し、室温で 30 分間静置する。
Note: 以下の作業工程では、湿潤器などを用いて切片を乾燥させないでください。
4. 溶液を除去した後、0.1% TritonX-100/PBS 100 μl を添加し、室温で 30 分間静置する。
5. 溶液を除去した後、Blocking Buffer 100 μl を添加し、室温で 30 分間静置する。
染色工程
1. 溶液を除去した後、一次抗体※ /Blocking Buffer 100 μl を添加し、室温で 1 時間静置する。 2. 溶液を除去した後、Blocking Buffer 100 μl で 2 回洗浄する。
3. β-Galactosidase 標識二次抗体 ※/Blocking Buffer 100 μl を添加し、室温で 1 時間静置する。
4. 溶液を除去した後、Blocking Buffer 100 μl で 2 回洗浄する。
5. Staining Solution 100 μl を添加し、37℃で 30 分間静置する。
6. 溶液を除去した後、PBS 100 μl で 3 回洗浄する。
7. 蛍光顕微鏡で観察する。
※ [ 抗体濃度の検討 ] に従って、適切な抗体濃度の検討を行ってください。
プロトコル6
ホルマリン固定パラフィン包埋(FFPE)組織切片用
抗原の賦活化
1. FFPE 組織切片 / スライドガラスを用意する。
2. 60℃で 1 時間静置する。
3. 室温で 15 分間静置する。
Note: 以下の作業工程では、湿潤器などを用いて切片を乾燥させないでください。
4. レモゾールに室温で 5 分間浸漬する。この操作をもう一度行う。
5. エタノールに室温で 5 分間浸漬する。
6. 90% エタノールに室温で 5 分間浸漬する。
7. 80% エタノールに室温で 5 分間浸漬する。
8. 超純水、PBS の順で浸漬し洗浄する。
9. 抗原賦活化を行う。
10. 超純水、PBS の順で浸漬し洗浄する。
染色操作
1. 組織切片の周囲に撥水ペンを用いて境界を作る。
2. Blocking Buffer 100 µl を添加し、室温で 30 分間静置する。
3. 溶液を除去した後、一次抗体※ /Blocking Buffer 100 µl を添加し室温で 1 時間静置する。 4. 溶液を除去した後、PBS 100 µl を添加し 3 分間静置し洗浄する。この操作をさらに 2 回行う。
5. β-Galactosidase 標識二次抗体 ※/Blocking Buffer 100 µl を添加し、室温で 1 時間静置する。
6. 溶液を除去した後、PBS 100 µl を添加し 3 分間静置し洗浄する。この操作をさらに 2 回行う。
7. Staining Solution 100 μl を添加し 37℃で 30 分間静置する。
8. 溶液を除去した後、PBS 100 µl を添加し 3 分間静置し洗浄する。この操作をさらに 2 回行う。
9. 蛍光顕微鏡で観察する。
※ [ 抗体濃度の検討 ] に従って、適切な抗体濃度の検討を行ってください。
参考文献
K. Noguchi, T. Shimomura, Y. Ohuchi, M. Ishiyama, M. Shiga, T. Mori, Y. Katayama, and Y. Ueno, Bioconjugate Chemistry 2020 31(7), 1740-1744.
DOI: 10.1021/acs.bioconjchem.0c00180
よくある質問/参考文献
C554: CLAMP F405-Signal Boosting
Revised May., 18, 2023


 を押して省略できます。
を押して省略できます。

