はじめに
細胞周期の制御機構は、細胞増殖と密接に関与しています。ひとつの細胞が二つの娘細胞を生み出す細胞分裂は 細胞周期を介して起こります。細胞周期の解析には、フローサイトメーターが汎用されています。DNA を蛍光色素 で染色しフローサイトメーターで測定することで、間期や M 期の割合を算出することが可能です。細胞周期を解析 する色素として、Propidium Iodide (PI) が広く使われます。しかし、PI を使って細胞周期を測定する場合は下記の 前処理が必要となります。
- 細胞の固定化 (PI には細胞膜透過性がありません )
- RNase 処理 (PI は DNA 選択性がなく、RNA も染色されます )
- コンペンセーション (PE と FITC フィルターで共染色する場合は補正の必要があります )
Cell Cycle Assay Solution は、細胞の固定化や RNase 処理を必要とせず、簡便な操作で細胞周期の解析を可能にす る製品です。また、試薬の調製なしに使用できる水溶液形態で、検出蛍光波長として Deep Red と Blue の 2 色があ り、実験系や使用される装置に合わせてお選びいただけます。固定化した細胞への適用も可能です。
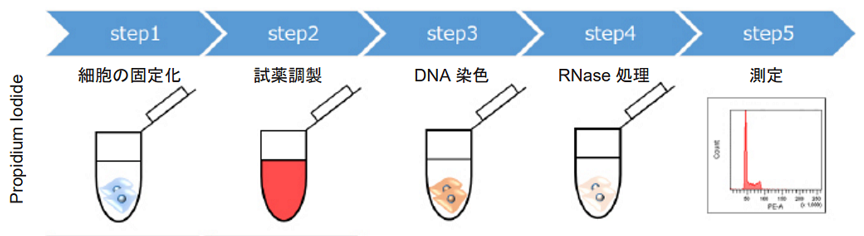
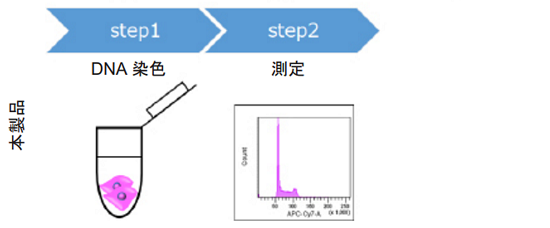
図 1 細胞周期解析プロセスの比較
内容
| 50 tests | ||
| C548 | Cell Cycle Assay Solution Deep Red | 250 µl x 1 |
| C549 | Cell Cycle Assay Solution Blue | 250 µl x 1 |
- いずれの製品も水溶液として提供しております。
保存条件
C548 : 遮光、-20℃ にて保存して下さい。
C549 : -20℃ にて保存して下さい。
必要なもの(キット以外)
- フローサイトメーター
- フローサイトメーター測定用のセルストレーナー
- インキュベーター (37℃ )
- マイクロピペット (100–1000 µl, 1–20 µl)
- コニカルチューブ
- 遠心チューブ
- Phosphate buffered saline (PBS)
使用上のご注意
- 未染色の細胞に比べ、本製品による染色後は細胞の前方、側方散乱光シグナル (FSC, SSC) が変化します。染色後 は適切なゲーティングを行い測定してください ( 図 5 参照 )。
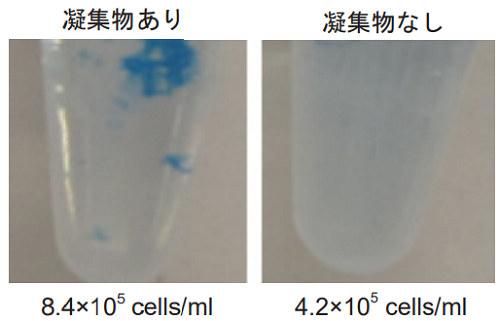
- 細胞数が多いと試薬添加後に凝集物が見られる場合があります。凝集物が見られる場合は細胞数を減らして試薬を 添加し、測定して下さい ( 図 7 参照 )。
溶液調製
調製操作は不要です。使用前に室温に戻して融解してからご使用下さい。
操作
未固定の細胞をサンプルとする場合
- 細胞密度 1–5×105 cells/ml の細胞懸濁液を準備する 。
- 細胞懸濁液を 1.5 ml チューブに 1 ml 入れ、300×g で 5 分間遠心する。
- 上澄みを除去し、PBS を 1 ml 加え細胞を再懸濁後、300×g で 5 分間遠心する。
- 上澄みを除去し、PBS を 0.5 ml 加える。
- Cell Cycle Assay Solution を 5 µl 加える。
- ボルテックスミキサーで撹拌混合し、遮光下、37℃ で 15 分間インキュベーションする。
- サンプルをフローサイトメーター測定用のセルストレーナーに通す。
- フローサイトメーターで測定する ( 表 1 参照 )。
固定化した細胞をサンプルとする場合
- 細胞密度 1–5×105 cells/ml の細胞懸濁液を準備する 。
- 細胞懸濁液を 1.5 ml チューブに 1 ml 入れ、300×g で 5 分間遠心し、上清を除去する。 3. 実験系に合った方法で細胞を固定化する。
例 ) 4% パラホルムアルデヒドで固定化する場合
- 細胞ペレットに4% パラホルムアルデヒド (PFA)/PBSを1 ml加え、室温で20分間静置する。
- 300 x g で 5 分間 遠心し、上清を除去する。
- PBS を 1 ml 加え細胞を再懸濁後、300 x g で 5 分間遠心する。
- 上清を除去し、PBS を 0.5 ml 加える。
例 ) 冷 70% エタノールで固定化する場合
- 細胞ペレットに冷 70% エタノールを 1 ml 加え、4℃ で 2 時間静置する。
- 300 x g で 5 分間 遠心し、上清を除去する。
- PBS を 1 ml 加え細胞を再懸濁後、300×g で 5 分間遠心する。
- 上清を除去し、PBS を 0.5 ml 加える。
- Cell Cycle Assay Solution を 5 µl 加える。
- ボルテックスミキサーで撹拌混合し、遮光下、37℃ で 15 分間インキュベーションする。
- サンプルをフローサイトメーター測定用のセルストレーナーに通す。
- フローサイトメーターで測定する ( 表 1 参照 )。
表 1 Cell Cycle Assay Solution を用い細胞周期を解析する際の
フィルターセッティング品コード 励起波長 蛍光波長 C548 633–647 nm 695LP もしくは 780/60 BP
※ 例 ) APC-Cy7 (BD 社 )C549 405–407 nm 450/50 BP
※ 例) Pacific Blue (BD 社 )※ LP: Long pass filter
※ BP: Band pass filter
実験例
HeLa 細胞の細胞周期解析
- 細胞密度 4–5 x 105 cells/ml の細胞懸濁液を準備した。
- 細胞懸濁液を 1.5 ml チューブに 1 ml 入れ、300 x g で 5 分間遠心した。
- 上澄みを除去し、PBS を 1 ml 加え細胞を再懸濁後、300 x g で 5 分間遠心した。
- 上澄みを除去し、PBS を 0.5 ml 加えた。
- Cell Cycle Assay Solution Deep Red もしくは、Cell Cycle Assay Solution Blue を 5 µl 加えた。
- ボルテックスミキサーで撹拌混合し、遮光下、37℃ で 15 分間インキュベーションした。
- サンプルをフローサイトメーター測定用のセルストレーナーに通した。
- フローサイトメーターにて測定した。
-
Cell Cycle Assay Solution Deep Red
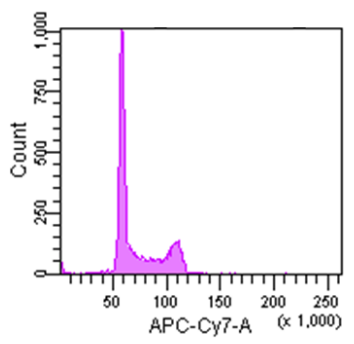
Excitation: 640 nm
Emission: 780/60 nm
-
Cell Cycle Assay Solution Blue
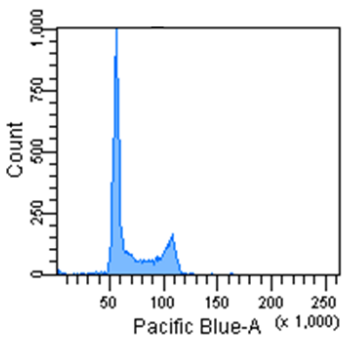
Excitation: 405 nm
Emission: 450/50 nm
Jurkat 細胞の細胞周期解析
- 細胞密度 4–5 x 105 cells/ml の細胞懸濁液を準備した。
- 細胞懸濁液を 1.5 ml チューブに 1 ml 入れ、300 x g で 5 分間遠心した。
- 上澄みを除去し、PBS を 1 ml 加え細胞を再懸濁後、300 x g で 5 分間遠心した。
- 上澄みを除去し、PBS を 0.5 ml 加えた。
- Cell Cycle Assay Solution Deep Red もしくは、Cell Cycle Assay Solution Blue を 5 µl 加えた。
- ボルテックスミキサーで撹拌混合し、遮光下、37℃ で 15 分間インキュベーションした。
- サンプルをフローサイトメーター測定用のセルストレーナーに通した。
- フローサイトメーターにて測定した。
-
Cell Cycle Assay Solution Deep Red
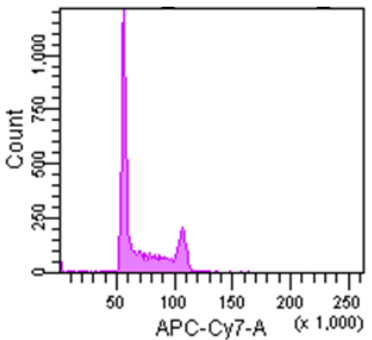
Excitation: 640 nm
Emission: 780/60 nm
-
Cell Cycle Assay Solution Blue
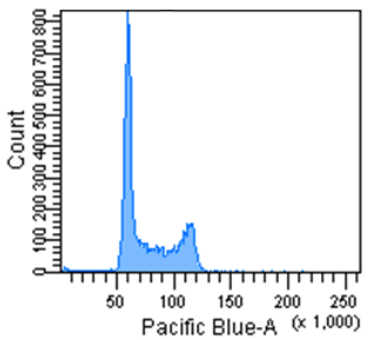
Excitation: 405 nm
Emission: 450/50 nm
トラブルシューティング
前方、側方散乱光シグナル (FSC, SSC) の変化について
未染色の細胞に比べ、本製品で細胞を染色すると FSC, SSC が変化します。 本製品で細胞染色後は FSC, SSC を調整して細胞全体をゲーティングするようにしてください。
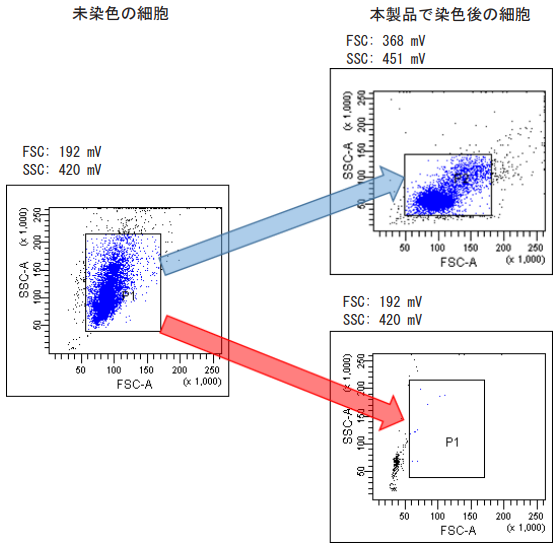
図 5 染色前後の FSC, SSC の変化
トリプシンの残存について
トリプシンが残存すると測定に影響します。細胞回収後の洗浄操作を確実に行ってください。
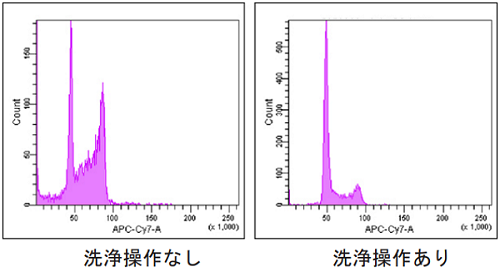
図 6 トリプシンの影響
試薬添加後に凝集物が見られる場合の対応
細胞数が多い状態で試薬を添加してインキュベートするとチューブ内に細胞の凝集物が見られ る場合があります。凝集物が見られる場合は細胞濃度を減らして試薬を添加して下さい。
-
細胞種 HeLa 細胞濃度 4.2–8.4 ×105 cells/ml 試薬添加量 5 µl インキュベート温度 37 ℃ インキュベート時間 15 分
図 7 細胞濃度の違いで見られる凝集物
C548_C549: Cell Cycle Assay Solution Deep Red/Blue
Revised Apr., 11, 2024


 を押して省略できます。
を押して省略できます。