はじめに
-Bacstain- Bacterial Viability Detction Kitは細菌を対象とした蛍光二重染色が可能な製品群です。下記に示した、異なる三つの染色原理をもつ蛍光染色試薬を組み合わせることで、それぞれの指標における二重染色画像が取得できます。
細菌の生存率は一般的には寒天培地を用いたコロニー形成法によって評価されますが、この手法では培養に長時間要することや、viable but nonculturable(VNC)状態の菌では生育が認められないといった問題点があります。
一方、蛍光染色法は細菌を培養することなく迅速・簡便に染色し、生存率の評価を行うことが可能です。
-Bacstain- Bacterial Viability Detction Kit -CTC/DAPIは、細菌の呼吸活性を指標とした生存率検出キットです。本キットに含まれるCTCは、細胞の呼吸活性に伴い生産されるNAD(P)Hにより還元を受け、蛍光性ホルマザン色素を生成することで生菌を選択的に染色します。DAPIはDNAのAT配列に特異的なマイナーグルーブバインダーで、膜損傷の有無に関わらず細菌内へ透過し核酸を染色します。
このことから、本製品では、それぞれの染色画像を解析することで全細菌数に対する呼吸活性を有する細菌の比率を求めることができます。
| コード | 製品名 | 組み合わせ |
| BS08 | -Bacstain- Bacterial Viability Detction Kit -DAPI/PI | 全菌/膜損傷 |
| BS09 本製品 |
-Bacstain- Bacterial Viability Detction Kit -CTC/DAPI | 呼吸活性/全菌 |
| BS10 | -Bacstain- Bacterial Viability Detction Kit -CFDA/PI | エステラーゼ活性/膜損傷 |
内容
| CTC (5-cyano-2,3-ditolyl tetrazolium chloride) | 10 mg ×4 |
| Enhancing Reagent | 700 μl ×1 |
| DAPI Solution | 25 μl ×4 |
保存条件
0‐5℃ にて保存して下さい。
必要なもの (キット以外)
- インキュベーター
- マイクロピペット(1000 μl, 1–20 μl)
- PBS(-)または生理食塩水
- 滅菌水
- 蛍光顕微鏡
使用上のご注意
本キットには溶液の入ったマイクロチューブのコンポーネントが含まれます。
チューブ内壁やキャップに溶液が付着していることがありますので開封前に遠心等によりチューブの底部に落としてからご使用ください。
プロトコル
プロトコルに準じた場合、本キット各4本組で約100検体分の測定が可能です。
- CTCならびにEnhancing Reagent を30分間遮光下で静置し、室温に戻す。CTCの入ったチューブ1本に対し、滅菌水750 μl を加えよく混合し、CTC Solutionとする。この時CTC濃度は50 mmol/l となる。a) DAPI Solutionを30分間遮光下で静置し、室温に戻す。
- 細菌をPBS(-)または生理食塩水に懸濁し、細菌の密度を 108-109 cells/ml に調整する。
- 細胞懸濁液 1 ml をマイクロチューブに移す。b)
- 細胞懸濁液を遠心分離する(5,000 × g、5分間)
- 上澄みを除去し、PBS(-)または生理食塩水 1 ml を加え懸濁する。
- 4., 5. の手順を2回繰り返す。
- 細胞懸濁液1 mlに対し下表に示した量の試薬を加えボルテックスミキサーで混合する。(終濃度:1 mmol/l)
CTC solution Enhancing Reagent 20 μl 5 μl - 37 ℃ にて 30分間 インキュベートする。c)
- 細胞懸濁液1 mlに対しDAPI solutionを1 μl加えよく混合する。(終濃度:2.8 μmol/l)
- 室温にて5分間インキュベートする。
- 蛍光顕微鏡で観察する。
| コンポーネント名 | Maximum Ex/Em | 推奨フィルター | 励起波長 | 蛍光波長 |
| CTC Solution | 430,480/630 | Texas Red | 520-600 nm | 555-705 nm |
| DAPI Solution | 360/460 | DAPI | 320-400 nm | 410-510 nm |
a) 溶解後のCTC溶液は-20 ℃で2週間保存可能です。
b) 染色時に培地成分が残っていると、CTCの非特異的な還元反応が起こりますので、染色前はPBS(-)や生理食塩水で洗浄後、置換して下さい。
c) CTCによる染色効率が低い場合は、CTC溶液を追加するかインキュベーション時間を長くしてください。CTC溶液を追加する場合は細胞懸濁液1 mlに対し最大添加量を100 μl/サンプルまでとして下さい。
実験例-1
Staphylococcus aureus(グラム陽性菌)の二重染色実験
- 液体培地(TSBYE) 5 ml を入れた試験管を2本準備し、細菌を培養(37 ℃、14~16時間)した。1本を生菌サンプルとし、もう1本を滅菌済サンプル(オートクレーブ滅菌 121 ℃、30分)とした。
- 培養後、菌をPBS(-)または生理食塩水に懸濁し、細胞密度を 108-109 cells/ml に調整した。生菌サンプルと滅菌済サンプルを7:3の割合で混合し、実験用サンプルとした。
- 細胞懸濁液 1 ml をマイクロチューブに移した。
- 細胞懸濁液を遠心分離した(5,000 × g、5分間)。
- 上澄みを除去し、PBS(-)または生理食塩水 1 ml を加え懸濁した。
- 4., 5. の手順を2回繰り返した。
- 細胞懸濁液にCTC Solutionを20μlとEnhancing Reagentを5 μl加えボルテックスミキサーで混合した。
- 37 ℃ にて 30分間 インキュベートした。
- 細胞懸濁液にDAPI Solutionを1 μl加えよく混合した。
- 室温にて5分間インキュベートした。
- 落射型蛍光顕微鏡で観察した。
DAPIにより全細菌を染色(青)し、CTCにより呼吸活性を有する細菌を染色(赤)したことが確認できる。
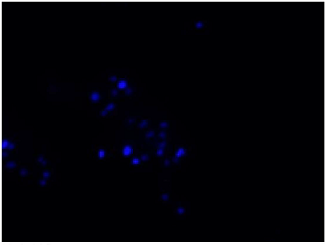
DAPI
Excitation filter 320–400 nm
Emission filter 410–510 nm
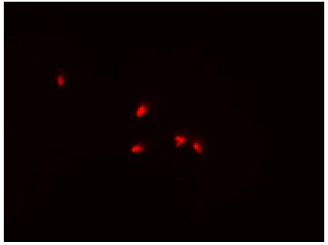
CTC
Excitation filter 520–600 nm
Emission filter 555–705 nm
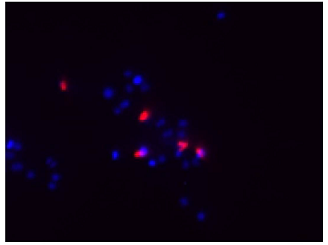
Merge
実験例-2
Escherichia coli (グラム陰性菌)の二重染色実験
- 液体培地(TSBYE) 5 ml を入れた試験管を2本準備し、細菌を培養(37 ℃、14~16時間)した。1本を生菌サンプルとし、もう1本を滅菌済サンプル(オートクレーブ滅菌 121 ℃、30分)とした。
- 培養後、菌をPBS(-)または生理食塩水に懸濁し、細胞密度を 108-109 cells/ml に調整した。 生菌サンプルと滅菌済サンプルを1:1の割合で混合し、実験用サンプルとした。
- 細胞懸濁液 1 ml をマイクロチューブに移した。
- 細胞懸濁液を遠心分離した(5,000 × g、5分間)。
- 上澄みを除去し、PBS(-)または生理食塩水 1 ml を加え懸濁した。
- 4., 5. の手順を2回繰り返した。
- 細胞懸濁液にCTC Solutionを20 μlとEnhancing Reagentを5 μl加えボルテックスミキサーで混合した。
- 37 ℃ にて 30分間 インキュベートした。
- 細胞懸濁液にDAPI Solutionを1 μl加えよく混合した。
- 室温にて5分間インキュベートした。
- 落射型蛍光顕微鏡で観察した。
DAPIにより全細菌を染色(青)し、CTCにより呼吸活性を有する細菌を染色(赤)したことが確認できる。
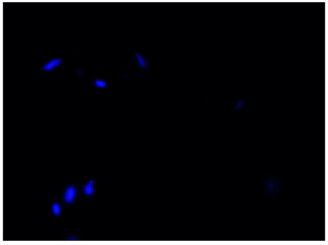
DAPI
Excitation filter 320–400 nm
Emission filter 410–510 nm
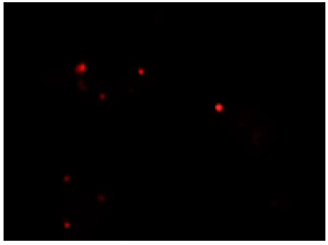
CTC
Excitation filter 520–600 nm
Emission filter 555–705 nm
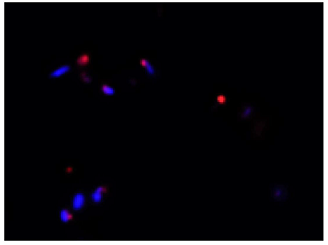
Merge
よくある質問/参考文献
BS09: -Bacstain- Bacterial Viability Detection Kit - CTC/DAPI
Revised May., 22, 2023


 を押して省略できます。
を押して省略できます。

