はじめに
BCECF の pKa は 6.97で、pH6.4から 7.6の範囲で直線的に蛍光強度が変化するため、細胞内のpH測定およびpH 変化の観察に適しています。BCECF は生理的条件では分子内のカルボキシル基がマイナスチャージを持つため、 細胞膜を透過できませんが、アセトキシメチルエステル化 (AM化)した中性分子の BCECF-AM は細胞膜を透過できます。細胞膜を透過した BCECF-AM は、細胞内のエステラーゼにより加水分解を受け BCECF となり、分子 周囲のpHにより蛍光強度が変化します。BCECFの励起スペクトルは 490 nm に極大波長を持ち、439 nm では pH 変化を受けません。そのため、439 nm および 490 nm の二つの励起波長で励起した 530 nm の蛍光スペクトル強度 比を測定することにより、試薬濃度や細胞の大きさに関係なく pH を求めることができます。
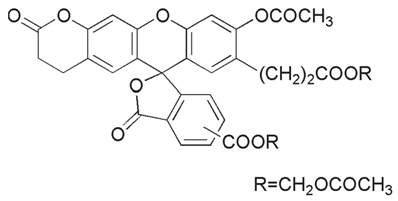
BCECF-AM C35H28O15 = 688.59
内容
| BCECF-AM | 50 µg x 8 |
| Dimethylsulfoxide(DMSO) | 1 ml x 1 |
溶液調製法
BCECF-AM 50 µg に適量の DMSO を加え、均一に溶解するとご希望の濃度の溶液に調製できます。 目的濃度に調製するための DMSO 使用量については、下記の式で算出してください。
- 72 µl の DMSO を加えた場合、約1mmol/l の溶液になります。
|
濃度 A (mmol/l) のBCECF-AM 溶液を調製したい場合の DMSO の使用量B (μl) |
使用例
下記の試薬濃度やインキュベーション時間は、必要に応じて最適化する必要があります。
- 0.2~10 mmol/l BCECF-AM 溶液となるように DMSO を加え溶解するa)。
- 調製した BCECF-AM/DMSO 溶液を細胞に使用される中性バッファーを用いて希釈するb)。
- BCECF を導入したい細胞 (細胞数:106cells/ml程度) に対して、終濃度が0.2~10 µmol/l になるように希釈した BCECF-AM バッファー溶液を加えるc)。
- 細胞を 10~60分間インキュベートする。
- 細胞を培地で洗浄する。
注意事項
a) 残ったBCECF-AM/DMSO 溶液は -20℃で保存してください。保存した溶液の使用に際しては、調製時と比べて着色あるいは蛍光が強く見られる場合は使用しないでください。BCECF の導入効果が低くなります。
b) バッファーで希釈した溶液は保存できません。また、BCECF-AM の細胞への取り込みが悪い場合は、Pluronic® F-127 などのデタージェントを使うと、導入効率が高くなる場合があります。 (Pluronic® F-127の濃度は 0.04%程度でご使用ください。)
c) BCECF-AM の希釈バッファー溶液を加える際の細胞培地は、血清を含まない培地あるいは、バッファーを用いてください。血清を含む培地では、AM 基が血清由来のエステラーゼにより加水分解を受け、導入効率が大幅に低下することがあります。
- 本製品には、ガラス製容器を使用しております。
保護手袋を着用するなど、お取扱に際してはご注意ください。
よくある質問/参考文献
B221: BCECF-AM special packaging
Revised Dec., 11, 2023


 を押して省略できます。
を押して省略できます。

