分解標識タンパク質が駆動するミトコンドリア特異的オートファジー
Mitochondria-specific autophagy driven by proteins acting as degradation tags
 |
岡本 浩二 大阪大学 大学院生命機能研究科 准教授 |
Abstract
Selective clearance of excess or unhealthy mitochondria is a fundamental process conserved from yeast to humans, contributing to mitochondrial quantity and quality control. This catabolic event primarily depends on autophagy, a cellular self-eating pathway that mediates transport of cytoplasmic components to lysosomes for degradation and is thus called mitophagy. Defects in mitophagy are thought to be associated with a myriad of disorders such as mitochondrial malfunction, heart/liver failure, neurodegeneration, aging, and cancer, underscoring the physiological relevance. In the last decade, numerous studies have demonstrated that specific proteins on the surface of mitochondria serve as receptors for Atg8 family members, ubiquitin-like modifier covalently conjugated to the phospholipid phosphatidylethanolamine and localized on the autophagosomal membranes, thereby promoting formation of autophagosomes surrounding mitochondria. During prolonged respiratory growth, the budding yeast Saccharomyces cerevisiae undergoes drastic mitophagy via Atg32, a mitochondrial outer membrane acting as a receptor for Atg8. In addition, Atg32 interacts with Atg11, a scaffolding protein that mediates assembly of core Atg proteins essential for autophagosome formation. Through these protein-protein interactions, Atg32 recruits the autophagy machinery to the mitochondrial surface and selectively facilitates sequestration of mitochondria into autophagosomes. Notably, basic principles underlying Atg32-driven mitophagy are shared with mammalian receptors, further highlighting the biological significance.
1.はじめに
ミトコンドリアは ATP 産生を担う真核細胞の主要な細胞小器官 (オルガネラ) であり、細胞のエネルギー需要に応じてその量が適切に調節されている。例えば、活発に増殖している対数増殖期の細胞ではエネルギー需要が高いため、ミトコンドリアの活性が上昇するとともに量も増える。一方、細胞が増殖を停止して静止期に入るとエネルギー需要も低くなるので、ミトコンドリアが余剰となる。また、電子伝達系で生じる副産物としての活性酸素種 (ROS) は酸化ストレスとなり、ミトコンドリアに障害を与えて機能不全を引き起こす。そのため細胞には、余剰または損傷ミトコンドリアを丸ごと隔離・除去することで、ミトコンドリアの量や品質を管理する機構が備わっていることが、近年の研究で明らかとなってきた 1)。この仕組みは、細胞の自食作用「オートファジー」を利用することから、「マイトファジー」(mitophagy, mitochondria autophagy) と呼ばれ、最近にわかに注目されている。
オートファジーは、細胞内の構成成分を非選択的かつ大規模に分解する経路であり、酵母からヒトまで保存された基本的な仕組みである 2)。最も典型的な例として、栄養飢餓誘導型オートファジーがよく知られている。細胞が窒素源飢餓などに曝されると、細胞内に隔離膜と呼ばれる 2 重膜でできた扁平な構造体が出現し、これがタンパク質やオルガネラを取り囲んでゆく。成長した隔離膜はやがて袋状となり、オートファゴソームが完成する。オートファゴソームはリソソーム (酵母や植物では液胞) と融合し、リソソームから供給されるタンパク質・脂質・核酸などの分解酵素によって速やかに分解される。タンパク質の細胞内分解においては、ユビキチン・プロテアソーム系も大きな役割を果たしているが、オルガネラのような巨大な構造体を丸ごと隔離・除去できるシステムは、オートファジーしか知られていない。重要なことに、オートファジーの仕組みは非選択的なバルク分解だけでなく、特定のタンパク質やオルガネラのみを隔離・除去する役割も果たしていることがわかってきた 3)。後者は選択的オートファジーと呼ばれ、マイトファジーもその一つである。
筆者らのグループは、単細胞のモデル生物である出芽酵母 Saccharomyces cerevisiae を用い、呼吸増殖後の静止期の細胞内でマイトファジーが劇的に誘導されることを見出した 4)。さらに別のグループと同時かつ独立に、マイトファジーに特異的かつ必須なタンパク質 Atg32 を同定し 4), 5)、その分子機能を明らかにするとともに、マイトファジーの選択性を規定する仕組みの一端を世界に先駆けて解明するに至った。その後の研究成果により、 Atg32 と同様の機能をもつ哺乳類マイトファジー駆動因子が次々に報告され、オートファジーに必須なユビキチン様タンパク質 Atg8 の受容体が分解標識タンパク質として働くという、生物種を超えて保存された共通原理が明らかになってきた。また、最近の研究から、マイトファジーの生理機能と病態発症のリンクが示唆されており、その生物学的意義に大きな関心が集まっている 6)。本稿では、筆者らの研究成果を中心に、これまでに明らかになった分解標識タンパク質駆動型マイトファジーの分子機構について概説する。
2.酵母マイトファジーを駆動する分解標識タンパク質
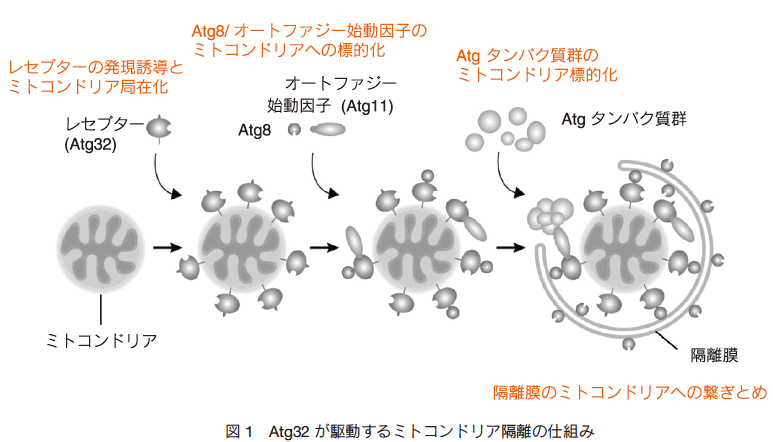
出芽酵母のミトコンドリア特異的オートファジーに必須な因子 Atg32 は、細胞が非発酵性の炭素源を含む培地で増殖する際、発現が強く誘導される。この培養条件では、ミトコンドリアでの ATP 合成が酵母の生存に必須であり、活発な呼吸によって ROS レベルが上昇する。同時に、細胞内の還元型グルタチオン量が減少し、これが引き金となって ATG32 遺伝子の転写誘導が起こると考えられる 7)。合成された Atg32 タンパク質はミトコンドリア表面に標的化・膜挿入されるとともに、直接的な結合により Atg8 をミトコンドリアにリクルートする(図 1)。 Atg8 ファミリータンパク質は生物種を超えて保存されているオートファジーの「実働因子」であり、リン脂質ホスファチジルエタノールアミンに共有結合して隔離膜に局在する 8)。このため、 Atg32-Atg8 相互作用は隔離膜形成をミトコンドリア表面へ限局させるのに寄与していると考えられる 9)。なお、 Atg32 の N 末端側ドメインには、 Atg8 の結合部位として機能するモチーフがあり 4)、 AIM (Atg8-family interacting motif) あるいは LIR (LC3-interacting region) と呼ばれる。
重要なことに、 Atg8 との結合だけでなく、 Atg32 は別のオートファジー関連タンパク質 Atg11 とも直接相互作用する(図 1) 4), 5)。 Atg11 は選択的オートファジーのための隔離膜形成に必須な Atg タンパク質の分子集合の足場として機能するオートファジーの「始動因子」であり 10)、Atg32-Atg11 相互作用はマイトファジーに不可欠と考えられる 9), 11), 12)。このように、 Atg32 はミトコンドリアの丸ごと分別・除去のための隔離膜形成の始動因子と実働因子を直接的にミトコンドリアへリクルートすることで、マイトファジーの選択性を規定している(図 1)。
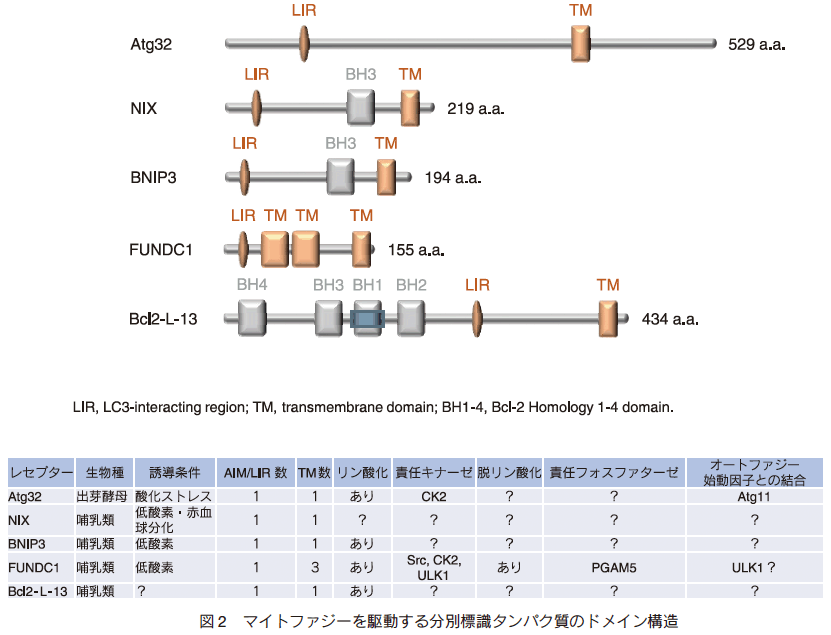
3.分解標識タンパク質の普遍性と多様性
最近、 Atg32 のように LIR モチーフによる LC3 (Atg8 の哺乳類ホモログ) 受容体としての機能をもち、膜貫通ドメインによってミトコンドリア表面へ膜挿入する因子が複数同定されている(図 2) 13)。加えて、 Atg32 を含むこれらのマイトファジー駆動因子に共通する重要なポイントが二つある。第一に、リン酸化や脱リン酸化などの翻訳後修飾を受けることで、 LC3 やオートファジー始動因子との結合が正または負に制御され、それによってマイトファジー活性が調節されている点である。第二に、特定の生理条件によってタンパク質の発現量が上昇、あるいは前述の翻訳後修飾が促進され、それによってマイトファジー誘導が調節されている点である。一方、マイトファジー誘導の生理条件は、酸化ストレス・低酸素・細胞分化などが知られており、それらに対応する分解標識タンパク質も様々である。
興味深いことに、 Atg32 欠損酵母細胞で哺乳類マイトファジーの駆動因子 Bcl2-L-13 を発現させたところ、微弱ながらミトコンドリアの分解が回復することがわかった 14)。このマイトファジー活性は Bcl2-L-13 の LIR モチーフに依存しており、かつ全てのオートファジー関連経路に必須な Atg7 を必要とする 14)。これらの知見から、 Bcl2-L-13 は Atg8 に相互作用し、オートファジーの仕組みを利用して酵母ミトコンドリアの分解を促進していると考えられる。すなわち、 Bcl2-L-13 は Atg32 の機能性ホモログであり、同様の仕組みで哺乳類マイトファジーを駆動しているのかもしれない。
4.おわりに
本稿では、マイトファジーを駆動する分解標識タンパク質について焦点を絞り、出芽酵母の駆動因子 Atg32 の分子機能とそれに類似した哺乳類タンパク質の特徴を紹介してきた。これらとは別に、ユビキチンが分解標識として働く仕組みがあり (酵母では見つかっていない)、パーキンソン病関連因子 PINK1/Parkin に依存したマイトファジーとして詳細に解析されている 15)。哺乳類細胞では、 Atg8 (LC3) 受容体駆動型とユビキチン駆動型の二つのタイプが存在しており、それぞれ相互補完的に働いているか、状況に応じて使い分けられている可能性も考えられる。マイトファジー不全が関連する病態とそれらの治療に向けて、今後のさらなる解析が待たれる。
| 著者プロフィール | |
| 氏名 | 岡本 浩二 (Koji Okamoto) |
|---|---|
| 所属 | 大阪大学大学院生命機能研究科 |
| 連絡先 | 〒565-0871 大阪府吹田市山田丘1-3 TEL : 06-6879-7970、 FAX : 06-6879-7970 E-mail : kokamoto@fbs.osaka-u.ac.jp |
| 出身学校 | 広島大学大学院理学研究科 |
| 学位 | 博士(理学) |
| 専門分野 | 分子細胞生物学 |
| 現在の研究テーマ | ミトコンドリア質・量管理の分子機構と生理機能 |