�����C�I�E�ɂ��S�ؑ����V������
Regulation of Cardiac Early Senescence by Reactive Sulfide Specie
 |
�����@���K ���R�Ȋw�����@�\�����w������ �i�����n���T���Z���^�[�j �S�z�V�O�i���������� ���C���� |
 |
���c�@��G ���R�Ȋw�����@�\�����w������ �i�����n���T���Z���^�[�j �S�z�V�O�i���������� ���� |
Abstract
�@Aging is the immortal risk factors for most human diseases, and characterized by a progressive loss of the ability of the organism to cope with stressors and to repair tissue damage. Transfiguration of a reduction/oxidation �iredox�j balance regulated by enzymes for production, elimination and metabolism of electrophilic substances �ielectrophiles�j is believed as one of key mechanisms underlying cardiovascular early senescence. Electrophilic signaling is mainly regulated by endogenous electrophiles that are generated from reactive oxygen species, nitric oxide, and the derivative reactive species of nitric oxide during stress responses, as well as by exogenous electrophiles including compounds in foods and environmental pollutants. We found that an endogenous electrophile, 8-nitroguanosine 3�f ,5�f -cyclic monophosphate �i8-nitro-cGMP�j, induces H-Ras-mediated cardiac early senescence through covalent modification �iS-guanylation�j of H-Ras. Reactive sulfide species �iRSS�j such as cysteine persulfides and polysulfides that are endogenously produced in cells are likely to be involved in 8-nitro-cGMP metabolism, while accumulation of RSS is also revealed to induce cardiomyocyte injury through mitochondrial hyperfission. In this review, we introduce recent understanding on the mechanism of cell senescence caused by redox imbalance in rodent heart, including suggestions for a new therapeutic strategy for cardiovascular disease.
�P�D�͂��߂�
�@��������i�ތ���Љ�ɂ����āA�V���͂����鎾���̎�v�ȃ��X�N���q�ł���A�זE�E�g�D�̘V�������������f�f���A�i�s��x�点��v�V�I�Ȉ�ËZ�p���J�����邱�Ƃ����N�����Љ�̎����ɕK�v���ƍl�����Ă���B�S���ɂ����Ă��A�S�؍[�nj�ɂ�����S�؍זE�̑����V�����S�@�\�̒ቺ�i�S�s�S�j��s�����̔����A�Ђ��Ă͓ˑR���̌����ɂȂ邱�Ƃ���������Ă���B��ʓI�ɁA�@�����`�q�Y���̍P��I�������A�A�j�_�����A�B�_���X�g���X�� 3 ���S�Ă̍זE�V���ɋ��ʂ��钇��v���ƍl�����Ă���B��X�͊����_�f�ɂ��k�N���I�`�h�����̌��ʂƂ��čזE���Ō`�������e�d�q���� 8-nitroguanosine 3�f, 5�f -cyclic monophosphate �i8-nitro-cGMP�j �������S�s�S���f���}�E�X�̐S���ő����~�ς��邱�Ƃɒ��ڂ��A 8-nitro-cGMP �ɂ�邪���`�q�Y�� H-Ras �̐e�d�q�C�� �iS-�O�A�j�����j ����� H-Ras �̍P��I���������S�؍זE�̑����V����U�����邱�Ƃ��ŏ��ɕ��� 1�j�B����A8-nitro-cGMP �̑�ӌn�Ƃ��Ē��ڂ����̂��������f�A�j�I���iH2S/HS�|�j�ł���B H2S/HS�|�͐e�d�q�����̕W�I�ƂȂ�V�X�e�C���iCys�j�� SH�iS�|�j��Ɖ��w�\���I�ɗގ����Ă���ANaHS ���u�ɂ�� 8-nitro-cGMP ������S�؍זE�V�����}�����ꂽ���Ƃ���AH2S/HS�|���e�d�q�����̑�ӁE��łɊւ����������j�������Ɨ\�z���ꂽ�B�������A�����ǃ��x���� 8-nitro-cGMP �� NaHS �� Cys-SH ��ƒ��ڔ������Ȃ��������Ƃ���A NaHS ����苁�j���̍��������������������Ƃ��ē����\���������ꂽ�B���̌�ACys-SH ��ɃC�I�E�������t������ Cys �p�[�X���t�B�h�iCysSSH�j�� Cys �|���X���t�B�h �iCysSS�in�jH�j ���e�d�q�����ƒ��ڔ������A���̑�ӁE��łɓ������j���q���� �i�����C�I�E�j �ł��邱�Ƃ����炩�ɂ��ꂽ 2�j�B���������m���̐ςݏd�˂���A�S���ł̊����C�I�E�~�ς��S�s�S���Â̐V���Ȑ헪�ɂȂ�Ɗ��҂����B�Ƃ��낪�A�S�؍[�nj�̑����V���S�؍זE�ł͊����C�I�E�������~�ς��Ă��邱�Ƃ����炩�ƂȂ�A�e�d�q�����݂̂Ȃ炸�A�����C�I�E�̒~�ς��܂��S�ؘV���U���Ɋւ��\���������Ă����B�{�e�ł́A�e�d�q�^���j�o�����X�̔j�]�ɂ�萶����S�؍זE�V���̕��q�@�\�Ƃ��̕a�Ԑ����I�Ӌ`�ɂ��āA�C�I�E��Ӑ���̎��_����T������B
�Q�D�S�ؑ����V���̃��h�b�N�X����
�@�|�{�זE�ɂ́u�w�C�t���b�N���E 3�j�v�ƌĂ�镪��̐���������A�זE�V���Ƃ́A���`�ɂ͍זE���� �i���B�j�ł��Ȃ��Ȃ�����Ԃ��s�t�I�ɋN�����Ă����Ԃ��w���B���̌����Ƃ��āA���F�̖̂��[�ی�ɓ����ƍl�����Ă���e�����A�̒Z�k�₻��ɔ��� DNA �����A�~�g�R���h���A�Ǎ^�X�[�p�[�I�L�V�h�W�X���^�[�[ �iSOD2�j �̔����ቺ�ɂ��_���X�g���X�����A�����`�q�Y���̊������Ȃǂ��w�E����Ă���B����זE�ł̓e�����A�����y�f �i�e�������[�[�j ����������Ԃɂ��邽�߃e�����A�����艻���A�V�����N����ɂ����Ƃ���Ă���B�̘̂V���ƍזE�V���Ƃ̊֘A�ɂ��Ă͋c�_���������̂́A����ɔ����đ�����V���זE���̓��ɔ�r�I�������݂������邱�ƁA�V���זE���牊�ǐ��T�C�g�J�C���Ȃǂ����傳��邱�Ƃ���A����ɂ��~�ς����V���זE���g�D��̂̋@�\�ቺ�������N�����U���ƂȂ�ƍl�����Ă���B
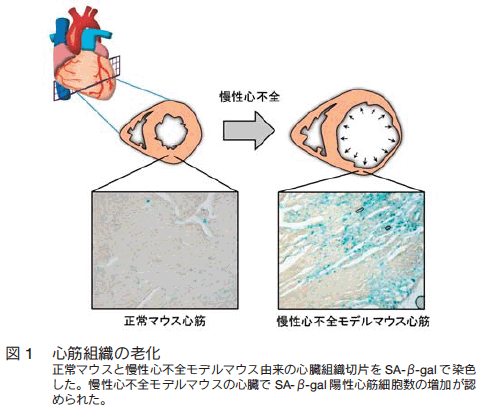
�@�זE�V�������o����ł��ȕւȕ]���@�Ƃ��āA�V���֘A �� �K���N�g�V�_�[�[ �iSA-��-gal�j ���F���m���Ă���B SA-��-gal ���F�͗l�X�ȃX�g���X�ɂ�胊�\�\�[���x�[�^�K���N�g�V�_�[�[�̔��������{���x�������邱�Ƃŗz���������������߁A�K�������זE�V���ɓ��ٓI�Ƃ����킯�ł͂Ȃ����̂́A�`�ԕω� �i�זE�̕��R����w�e���N���}�`���\���iSAHF�j�j �� p53�A Rb �^���p�N���Ȃǂ̔��������Ƃ������ڍׂȉ�͂��s���O�i�K�]���Ƃ��čL��������Ă���B��X�̓X�g���X�U�����̖����S�s�S���f���}�E�X�̐S���g�D�ɂ����āA SA-��-gal �z���̐���S�؍זE�����L�ӂɑ������Ă��邱�Ƃ����o���� �i�} 1�j�B���̘V���S�ؑg�D�ł͊����_�f �ireactive oxygen species: ROS�j �⊈�����f�� �ireactive nitrogen species: RNS�j �ƍזE���O�A�j���k�N���I�`�h�Ƃ̔����ɂ�萶������ 8-nitro-cGMP ��������������Ă���A��X�� 8-nitro-cGMP �ɂ�邪���`�q�Y�� H-Ras �̎_���I�@�\�C�����S�ؑ����V����U�����錴���ƂȂ邱�Ƃ𖾂炩�ɂ����B���̒m���́A�X�g���X���I���ꂽ�g�D�ɂ�����e�d�q�����̒~�ς��זE�����V����U�������v���ƂȂ邱�Ƃ������������Ă���B
�R�D�����C�I�E�̐����E��ӂƃ��h�b�N�X�V�O�i������
�@�ܗ��A�~�m�_�ł���V�X�e�C�� �iCys�j �́A�^���p�N�����\������A�~�m�_�̒��ł����ɋ��j���������A������̓��Ő��������e�d�q�����̗ǂ��W�I�ƂȂ�B�q�g�Q�m���ɂ͖� 214,000 ���� Cys ���R�[�h����Ă���A���̂��� 10-20�� ���x�����h�b�N�X�����̍��� Cys �i�����I pH �̏�ԂŃv���g�����𗣂����`�I�[����j �����ƍl�����Ă��� 4�j�B�����ɑ��݂��鑽���̉��w�����́A ROS �� RNS ����� ROS/RNS �R���̓������e�d�q�����Ɠ��l�A���q���ɑ��݂��郌�h�b�N�X�A�N�e�B�u�� Cys �����^���p�N�� �i�Z���T�[�^���p�N���j ��W�I�Ƃ��A����Ɖ��w�I�ɋ��L�������邱�ƂŁA�Z���T�[�^���p�N���̍\����@�\ �i�Ⴆ�y�f�����Ȃǁj ��ω������A�����̃V�O�i���`�B�o�H�ɉe����^���� 5, 6�j�B ROS �� RNS �ɂ��^���p�N���̖|���C�����t�I�Ȃ̂ɑ��A�e�d�q�����̓^���p�N���ƈ��肵�����L �iC-S�j �������`�����邱�ƂŁA�s�t�I�Ȗ|���C�����N�����B�^���p�N���C���̉t���������ւ̃V�O�i���`�B�̎������𐧌䂷�邱�Ƃ��l����ƁA�������������O�̐e�d�q�����̕������I�ɂ��U�������^���p�N���̕s�t�I�ȋ@�\�C�����A�������ǃ��X�N�����߂錴���ƂȂ邱�Ƃ��z�肳���B
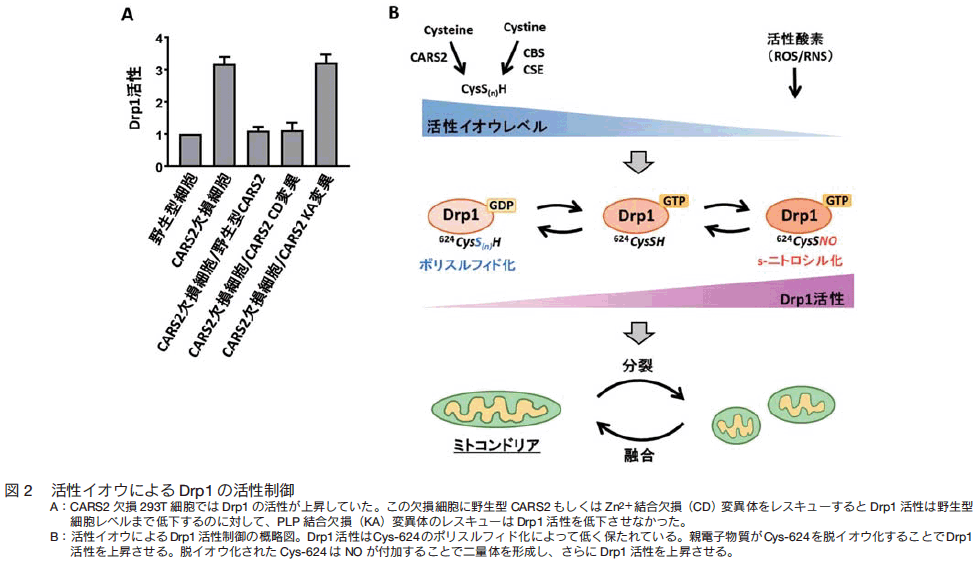
�@�e�d�q�����̑�ӁE������S�����������j�����Ƃ��Ē��ڂ���Ă����̂� RSS �ł���B�ғŃK�X�Ƃ��Ēm���闰�����f (H2S) �͋��j���̍����C�I�E���q���܂�ł���A���NJg����p��S�����ቺ�i�l�H�~���U���j�A�C�n�̋L�������ȂǑ��ʂȖ�p������ 7�j�B�ŋ߂ł́AH2S ���H�������ɂ��X�g���X��R���l���≄������ 8�j�A������̌��Ǔ���זE���B���q�Y��������������ǐV�� 9�j�A����уT�[�`���C���E�A�V�����y�f �iSIRT1�j ������������ǂ̗������₸�艞�͒�R���̈ێ��ɂ��ւ���Ă���A����זE�ɂ����� H2S �̎Y���ቺ�����ǘV���̌����ƂȂ邱�Ƃ�����Ă��� 10�j�B���̂悤�Ȍo�܂���AH2S ����_�����f���_���Y�f�ɑ�����O�̃K�X��V�O�i������q���Ƃ���r���ۂ��l�������o�Ă����B�������AH2S ���V���𐧌䂷�镪�q���J�j�Y���͐����悭�킩���Ă��Ȃ��BH2S �̎_�𗣒萔 �ipKa�j �� 6.76 �ƒႭ�A�����I pH (7.4�t��) �̗n�t���ł� H2S �� 80�� ���������f�A�j�I�� (HS�|) �̏�Ԃő��݂���B�Ƃ��낪�A HS�| �͎����Ǔ��� 8-nitro-cGMP �Ȃǂ̎ア�e�d�q�����Ƃ͒��ڔ��������A�J�ڋ�����G�}�Ƃ��ċ����������ꍇ�̂� HS�| �̋��j�u����ӕ� �i8-SH-cGMP�j ������B�זE�� 8-nitro-cGMP �̏����ɂ� 24 ���ԑO���� NaHS �����u����K�v�����邱�Ƃ���AH2S/HS�| �͍זE���ł�苁�j���̍��� RSS ���̂���邽�߂́u��v�Ƃ��ē����\�����l������B�����āAH2S/HS�| �����y�f���ƐM�����Ă����V�X�^�`�I�j�� �� �V���^�[�[ �iCBS�j ��V�X�^�`�I�j�� �� ���A�[�[ �iCSE�j ���V�X�`������� Cys �p�[�X���t�B�h �iCys-SSH�j �����邱�Ƃ����炩�ɂ���ACysSSH ���܂ރ^���p�N���|���X���t�B�h���e�d�q�����̒��ړI�ȑ�ӁE������S�� RSS �ł��邱�Ƃ������ꂽ 2�j�B���ہA RSS �ƑI��I�ɔ������� monobromobimane ��p�����A�_�N�g�[����͂���A�}�E�X�S���� CysSSH ��O���^�`�I���p�[�X���t�B�h �iGSSH�j ���� �� M ���x�����݂��邱�Ƃ����炩�ɂȂ��Ă����B�Ƃ��낪�A�������ނ̐S���ɂ� CBS �� CSE �^���p�N�����قƂ�ǔ������Ă��Ȃ����Ƃ��킩��A�ʂ� RSS �����o�H�i�y�f�j�����݂���\���������Ă����B��X�͐Ԓr�E�F�J�O���[�v��ƘA�g���A�M���ނ̍זE���~�g�R���h���A�ɋǍ݂��� cysteinyl-tRNA synthetase �iCARS2�j �� RSS �̎傽�鐶���y�f�ł��邱�Ƃ����o���� 11�j�BCARS2 �͐S�������łȂ��g�D���ՓI�ɔ������Ă���ACysSH ����Ƃ��� CysSSH �������v�y�f�ł��邱�Ƃ��킩���Ă����i�} 2�j�B
�S�D�����C�I�E�ɂ��~�g�R���h���A�i���Ǘ�����
�@�זE�V���̂�����̌����Ƃ��āA�~�g�R���h���A�i���Ǘ��ُ킪�w�E����Ă��� 12�j�B CARS2 ���� HEK293T �זE����p���Č`�ԋ@�\����͂������ʁA�쐶�^�זE���Ɣ�ׂ� CARS2 �����זE�ł̓~�g�R���h���A�ʐς���ѐ��̌����ƁA����ɔ������d�ʂ�_�f����x�̒ቺ���ώ@���ꂽ 11�j�B�~�g�R���h���A�̕i���Ǘ��͕���ƗZ���̃T�C�N���ɂ���Đ��䂳��Ă���A����E�Z���Ƃ��Ƀ��h�b�N�X�������� GTP �����^���p�N�� �iG �^���p�N���j �ɂ�茵���Ɋ������߂���Ă���B�~�g�R���h���A����̓_�C�i�~���l G �^���p�N�� dynamin-related protein1 �iDrp1�j �ɂ���ēI�m�ɐ��䂳��Ă���A�q�g����у}�E�X�� Drp1 �^���p�N���� NO �ɂ�� C ���[�� Cys-644 �c������ 2 �ʑ̉����邱�ƂŊ���������邱�Ƃ�����Ă��� 13�j�B��X�̓��b�g Drp1 �^���p�N����p���āA�q�g�E�}�E�X Drp1 �� Cys-644 �ɑ������� Cys-624 �� SH ��|���C�I�E������Ă��邱�Ƃ𖾂炩�ɂ����BCARS2 �����זE�ł� Drp1 �̃|���C�I�E�����x�����������ቺ���Ă����BCARS2 �����זE�ɖ쐶�^ CARS2 ��������ƃ~�g�R���h���A����� Drp1 �������������ɗ}������A����ɔ����Ė��d�ʂ�_�f����x�̒ቺ�������B CARS2 �� tRNA �����y�f����������j�Q�����ψّ� �iCD�j �������Ă����l�̉��ʂ��F�߂�ꂽ�̂ɑ��A CARS2 �̃p�[�X���t�B�h���������ɕK�v�� pyridoxal phosphate �iPLP�j �������ʂ̃��W����u�������ψّ� �iKA�j �������Ă��~�g�R���h���A�����}�����ʂ͔F�߂��Ȃ������B�ȏ�̌��ʂ��A�~�g�R���h���A�i���Ǘ��𐧌䂷�� Drp1 �������C�I�E�ɂ�芈�����߂���Ă��邱�Ƃ����炩�ƂȂ��� �i�} 2�j�B����܂� G �^���p�N���̊����́A GTP/GDP exchange factor �iGEF�j �� GTPase activaing protein �iGAP�j �̃o�����X�ł̂����ɐ��䂳�����̂ƐM�����Ă����B�{�m���́A G �^���p�N�� Drp1 �̊����� Cys �̃|���C�I�E�����x���ɂ���Ē��߂����Ƃ����S���V�����T�O�������̂ł���B����A�~�g�R���h���A�Z�����i G �^���p�N���ł��� Mfn1, Mfn2, Opa1 �ł͌����ȃ|���C�I�E���V�O�i�����ώ@���ꂸ�A CARS2 �����זE�Ƃ̈Ⴂ���F�߂��Ȃ������B�^���p�N���ɂ���Ē���Ԃ̃|���C�I�E�����x�����قȂ邱�Ƃ��l����ƁAMfn1, Mfn2, Opa1 �Ȃǂ̃^���p�N�� Cys �|���C�I�E���́A�|��㑬�₩�ɒE�C�I�E������Ă���\�����l������B
�T�D�Ҍ��X�g���X�ƐS�ؘV��
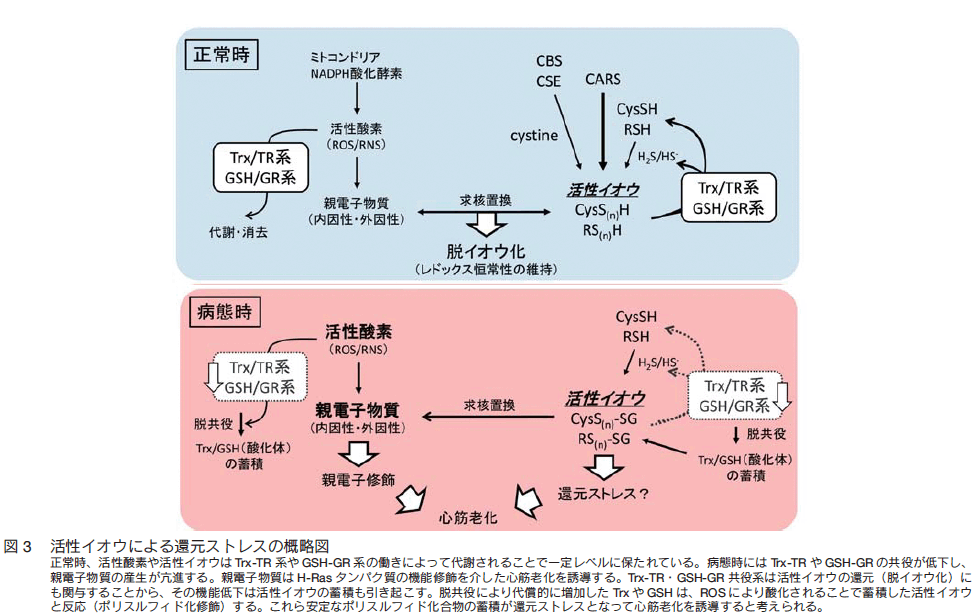
�@�D�C�������͗l�X�� ROS/RNS �����y�f�V�X�e����ᕪ�q�̍R�_������������Ă���B�Ⴆ�A�e�d�q�����ɂ�� Keap1/Nrf2 �V�X�e���������������ƁA�w���I�L�V�i�[�[-1 �iHO-1�j ��O���^�`�I�� S-�g�����X�t�F���[�[ �iGST�j�A�`�I���h�L�V�� �iTrx�j /Trx �Ҍ��y�f �iTR�j �A�O���^�`�I�� �iGSH�j �� GSH �Ҍ��y�f �iGR�j �Ƃ������Ҍ������̔������U�������B�������A�����I�Ȑe�d�q�������I�ɂ���ĊҌ������̔����U���������ƁA���x�͋t�ɊҌ��^ GSH �� NADPH �ʂ��������A�Ҍ��X�g���X���U�������B Rajasekaran ��́A�q�g ��B �N���X�^�����ψٔ����}�E�X���_���I�Ҍ��X�g���X��U�����A�^���p�N���ÏW�^�̐S�؏ǂ�悷�邱�Ƃ������邱�ƂŁA�Ҍ��X�g���X�Ƃ����T�O����� 14�j�B Keap1/Nrf2 �V�X�e���͊��X�g���X�ɑ��鐶�̖h��V�X�e���Ƃ��Ĕ��ɏd�v�Ȗ������ʂ����Ă���A Nrf2 �����}�E�X���_���X�g���X�ɑ��ĐƎ㐫���������Ƃ�����Ă��� 15�j�B���������̈���ŁA Nrf2 �̎����I���������Ҍ��X�g���X��U�����A���ʓI�� ROS �������������A�S�؏ǂ�悷�邱�Ƃ�����Ă��� 16�j�B Nrf2 �̊������� HO-1 �̔��������邪�A HO-1 �͎_�f���g���ăw���̕����𑣐i����y�f�ł���A���ʂƂ��ăr���x���W���A��_���Y�f�A�V�� Fe2�{ ������BFe2�{ �����͓S���R�̖����S�s�S���҂ɑ��ėL���ƍl�����Ă������A�ŋ߂ł͋t�Ƀ~�g�R���h���A�̗V�� Fe2�{ �ʂ����炷���Ƃ��S���̎��ÂɗL���ł��邱�Ƃ��Տ��������疾�炩�ɂ���Ă��� 17�j�AHO-1 �ɂ��V�� Fe2�{ �ʂ̑������~�g�R���h���A�S�ߕ��ׂ���ĊҌ��X�g���X�U�����S�@�\��Q��U�����Ă���\�����l������B
�@��X�͍ŋ߁A�S�؍[�nj�̃}�E�X�S���ɂ����āA���ɍ[�ǎ��ӗ̈�ɂ����Ċ����C�I�E �isulfane sulfar�j ���~�ς��Ă���A����ɔ����ĐS�ؑ����V�����U������Ă��邱�Ƃ����o���Ă���B SA- ��-gal �z���S�؍זE�ł̓~�g�R���h���A���ߏ�ɕ��Ă�����̂́ADrp1 �� GTP ���������͑������Ă��炸�A�ނ��� Drp1 �^���p�N�������ʑ̉� �i�ÏW�́j ���`�����Ă邱�Ƃ��킩���Ă����B Drp1 ���ʑ̉��͊Ҍ����u�ɂ��������邱�Ƃ���A Cys �W�X���t�B�h �i�܂��̓|���X���t�B�h�j �d������������ł���ƍl������B�S�؍זE�� Drp1 ���ʑ̉���͕킷�邽�߂ɂ́A��_�f�X�g���X�����łȂ��A RSS �~�ς��K�v�ł��邱�Ƃ��킩���Ă����BRSS �̊Ҍ����� �i�E�C�I�E���j �� Trx �� GSH �n����ċN���邱�Ƃ�����Ă��� 18�j�B�����̒m�����܂Ƃ߂�ƁA�Ҍ��X�g���X�Ƃ� �i��_�f�X�g���X�Ȃǂ̔��I�ɂ��j Trx/TR �n�� GSH/GR �n�ő�ӊҌ��ł��Ȃ��Ȃ��� RSS ���~�ς�����Ԃ��Ӗ�����̂�������Ȃ��i�} 3�j�B
�U�D�I����
�@������Љ�n�܂���錻��ɂ����āA�����X�N�̒�ʋZ�p�J���⌒�N�����̂��߂̈�ËZ�p�J���͕K�v�s���ł���A�����C�I�E���������̖�����������V�����w�╪��ƂȂ邱�Ƃ͊ԈႢ�Ȃ��B RSS ���邢�͊��e�d�q������ RSS �Ƃ̔�����ӕ����A�q�g�̍זE�E�g�D�V�������������X�N��\������V���Ȏw�W�ƂȂ�\����������Ă����B�܂��A�^���p�N�����Ɋ܂܂�� RSS ���A�^���p�N�����g�̕i�����Ǘ����邱�ƂŁA���̍y�f�����≺���G�t�F�N�^�[���q�Ƃ̑��ݍ�p�𐧌䂵���邱�Ƃ��킩���Ă����B RSS �Ƃ��̐����E��ӌn�̔����͓��k��E�Ԓr�F�͋������͂��߂Ƃ������{�l�����҂̍v�����傫���A����킪���𒆐S�ɉv�X���W���Ă�����������ɂȂ邾�낤�B
| ���҃v���t�B�[�� | |
| ���� | �����@���K �iAkiyuki Nishimura�j |
|---|---|
| ���� | ���R�Ȋw�����@�\�����w������ �i�����n���T���Z���^�[�j �S�z�V�O�i���������� ����������w�@��w�E�����Ȋw��U |
| �A���� | ��444-8787 ���m������s���厛�����R 5-1 Tel&Fax �F�@0564-59-5563 E-mail �F�@aki@nips.ac.jp |
| ���݂̌����e�[�} | G �`�����A���h�b�N�X�V�O�i�� |
| ���� | ���c�@��G �iMotohiro Nishida�j |
| ���� | ���R�Ȋw�����@�\�����w������ �i�����n���T���Z���^�[�j �S�z�V�O�i���������� ��B��w��w�@��w�����@�E�n�����{�ݓ����� ����������w�@��w�E�����Ȋw��U |
| �A���� | ��444-8787 ���m������s���厛�����R 5-1 Tel&Fax �F�@0564-59-5560 E-mail �F�@nishida@nips.ac.jp |
| ���݂̌����e�[�} | �����Z�v�g�[���A�S�z�_�C�i�~�Y�� |