 |
| トップページ > 動物実験の3Rにおける国内外の動向 National and International trends of 3Rs in animal experiment |
 |
||||||||||||||||||||||
動物実験の3Rにおける国内外の動向
|
||||||||||||||||||||||
 |
小島 肇夫
国立医薬品食品衛生研究所 安全性生物試験研究センター 薬理部 新規試験法評価室 室長 |
【要約】
There is slow, steadily progressing the movement of 3Rs (to Replace them with non-sentient alternatives, to Reduce to a
minimum the number of animals used, and to Refine experiments which used animals so that they caused the minimum pain and distress) of animal experiments in Japan.
The Japan Health Sciences Foundation established the Center for Accreditation of Laboratory Animal Care and Use in 2007.
With the purpose of assessing and verifying compliance with the “Basic Guidelines for Proper Conduct of Animal Testing and Related Activities in the Research Institutions under the Jurisdiction of the Ministry of Health, Labour and Welfare (MHLW)”, the objective of the center is to promote the optimum enforcement of scientific animal testing. Other Jurisdiction systems have been established by successive in Japan.
On the other hand, MHLW created the Japanese Center for the Validation of Alternative Methods (JaCVAM) at the National Institute of Health Sciences (NIHS) in 2005. JaCVAM has promoted the 3Rs in animal experiments for the evaluation of chemical substance safety and established guidelines for new alternative experimental methods through international collaboration for 5 years. Many Japanese colleagues have supported JaCVAM activities by performing validation studies and peer reviews and by providing regulatory acceptance for new alternative experimental ethods. Furthermore, we must push forward with international harmonization efforts in accordance with the International Cooperation on Alternative Test Methods (ICATM) framework, which was organized in April, 2009. We think that developments and continued activities of these centers are key contributions in 3Rs.
We expect these Japanese activities may contribute to the International harmonization in 3Rs.
キーワード:
動物実験代替法、代替法、バリデーション、第三者評価、3R
1.国内の動向-1-
1.1「動物愛護及び管理に関する法律の改訂」および関連指針
昭和48年(1973)に制定された「動物の愛護及び管理に関する法律(以後、動愛法と記す)」が2006年(平成18年)6月、環境省より施行され、第41条 動物を科学上の利用に供する場合の方法、事後措置等が改訂された1)。これまでの、“できる限り動物に苦痛を与えない方法によって実験を行わなければならないこと”に加え、“できる限り動物を供する方法に代わり得るものを利用すること、できる限りその利用に供される動物の数を少なくすること等により動物を適切に利用することに配慮するものとすること”が付記された。さらに、「実験動物の飼養及び保管並びに苦痛の軽減に関する基準」が環境省より告示された2)。その基本的な考え方には、動物を科学上に利用することは必要不可欠であるので、3R(Reduction:実験動物の削減、Refinement:実験動物の苦痛の軽減、Replacement:実験動物の置き換え)を徹底するために、適正な飼養および保管並びに科学上の利用に努めることが記載されている。加えて、環境省は平成18年10月「動物の愛護及び管理に関する施策を総合的に推進するための基本的な指針」を定めた3)。この中では、実験動物の適正な取扱いの推進について述べられている。
これらを受け、同時期に文部科学省4)、厚生労働省5)、農林水産省6)が関連「研究機関等における実験動物の実施に関する基本指針」を告示した。動物実験責任者の責務、動物実験委員会の設置、機関内規定の策定、動物実験計画の承認、データの信頼性を確保する観点から、適切な動物実験方法の選択、動物実験等の施設お
よび設備を踏まえて動物実験計画を立案し、適正に実施することが記載されている。実験方法の選択には動物実験代替法(以下、代替法と記す)の利用、実験動物の選択、苦痛の軽減への配慮が明記されている。
さらに、同時期に日本学術会議は「動物実験の適正な実施に向けたガイドライン」を示している7)。動愛法の基本指針を踏まえて、各研究機関が動物実験等に関する規定を整備するに際してモデルとなる共通ガイドラインを作成した。この他にも、日本実験動物学会、日本薬理学会、日本トキシコロジー学会、日本生理学会、日本神経科学会、日本実験動物協会などがそれぞれに指針を示している8)。
さて、動愛法には附則第9条において、「政府は、この法律の施行5年後を目途として、新法の施行の状況について検討を加え、必要があると認めるときは、その結果に基づいて所要の措置を講ずるものとする」とされている。これに基づけば、平成23年度を目途として施行状況を検討し、必要であれば法改正を行うことになる。実際、中央環境審議会動物愛護部会において、動物愛護管理法見直しに向けた議論が平成22年6月より進んでいる9)。この中で、実験動物の福祉が議題にあがっており、どのような追加記載がなされるのか注目していきたい。ただし、混同がないように、用語を正確に区別しておきたい。環境省が扱っているものは、「実験動物」であり、一方、その他省庁が扱っているのは、「動物実験」である。改訂が検討されているものは、「実験動物」であり、「動物実験」の規制が今後どう改正されるのか定かでない。
ところで、5年前の動愛法の改訂にあたり、3Rの原則が導入された理由について考えてみたい。これについては、鍵山が興味深い記述を残している10)。すなわち、3Rは国際原則であり、先進国で3Rを法令で謳っていない国は日本以外に見当たらなかったこと、研究論文のレフエリーの指摘事項の背景に3Rの原則の非明文化があったこと、我が国の製薬会社は欧米からアウトロー呼ばわりされ、国際展開に苦戦していたことがその理由であると記載している。日本の3Rの必要性は、動物福祉のためでなく、国際社会の中での生き残り、科学水準や国際経済力の維持のためのようである。今回の動愛法の改正によっても、この考え方が中心であろう。
1.2 動物実験施設の第三者認証機関
日本学術会議の「動物実験の適正な実施に向けたガイドライン」には、実験動物等の適正化に必要な教育訓練、自己点検・評価および検証ならびに情報公開に関する記述がある7)。この自己点検・評価には、「当該機関以外の者による検証を行うことを考慮する」と示されている。この検証機関として、米国ではAAALAC(Association for Assessment and Accreditation of Laboratory Animal Care)が国際認証をできる組織としてよく知られているが11)、日本ではこれまで当該機関以外の者が評価する公的な仕組みがなかった。この当該機関以外の者による審査を担当する組織として、2007年、財団法人ヒューマンサイエンス振興財団が第三者認証機関を設立し12)、公私立大学実験動物施設協議会、国立大学法人動物実験施設協議会13)、日本動物実験協同組合14)など複数の認証制度においても審査が進んでいる。日本においても本格的な当該機関以外の者による検証が始まったことを意味している。
2.国際動向
これまで説明してきた動愛法や動物福祉問題はすべて欧米にその起源が遡る。そこで、我が国の現状を客観的にみるため、欧米諸国の仕組みについて確認しておきたい。
2.1 EUの動向
欧米諸国には、前述した「実験動物」と「動物実験」の線引きはない。例えば、英国はAnimal Actで3つの免許制度を導入している15)。実験実施施設の指定、実験者の免許、実験計画の審査および免許の交付である。ところが、この法律はEUの法律と比べ表現が弱いとされており、2013年には改訂を予定している。このEUの法律とは、欧州議会が、EUの研究室で使用されている年間1200万以上の実験動物を規定するEU指令609-86に代わる新しいものであり、2010年9月に改正案の採用が決議され、ヨーロッパの多くの加盟国に、動物実験の水準向上を促した16)。以下が特記すべき事項である。
- チンパンジーなどの類人猿の使用禁止(一部の例外を除く)。
- 事前の倫理的・科学的な評価の権威化。
- 実験動物のすべてのブリーダー、サプライヤー、ユーザが、機器や動物のケージの選択およびトレーニング等に関する法令の順守。
- EUと加盟国レベルにおける医学研究や教育などを含むすべての分野での、非動物の方法の開発および推進。
このようなEUの思想、法律的な問題が経済にまで波及した事例が、化粧品開発における動物実験の規制問題17)およびリーチ法(REACH:Registration, Evaluation, Authorisation and Restriction of CHemicals)問題である18)。
化粧品の規制に関しては、2003年に化粧品指令7次改正が公布され、2009年3月に代替法が確立されている試験がある場合には、① EU域内での動物試験の完全禁止、②動物試験した製品、動物試験をした原料を含む製品の販売禁止が決められている17)。さらに、EU委員会は、期限内の開発が困難と判断された試験法の場合には、2013年まで延長する法案を提出している。これに対応すべく、EUでは欧州化粧品工業会(COLIPA:European Trade Association for the Cosmetic, Toiletry and Perfumery Industry)19)と欧州代替法評価センター(ECVAM:European Centre for the Validation of Alternative Methods)20)が共同で試験法の開発、バリデーションおよび専門家による第三者評価(以後、第三者評価と記す)を進めている。
一方、REACHとはすでにEU市場に流通している約3万の化学物質に関し、その製造・輸入を行う事業者は、その安全性データなどを揃え、登録することが義務つけられる規制を指す。登録、評価、認可、制限の総称である18)。この背景にはEUで化学品会社が27,000社(売上額590billion€)あり、170万人の従業員、国際市場の33% を占めている事情がある一方、職業性皮膚炎の治療費に3million€/日、約600million€/年が必要であるとともに、既存化学物質86% の毒性データが不足していることに端を発している21)。この安全性評価はハザードベースでなく、リスクベース(ハザードと曝露評価)が中心である、2009年までに事前登録された約18万の化学物質について、70% の試験を2017年までに実施しなければならない。実験を行う場合にはITS (Integrated Testing Strategies)という戦略に従い、Read-across という関連物質情報の調査、構造活性相関(QSAR:Quantitative Structure-Activity(またはAffinity)Relationship)などのin silico の利用、代替法を優先せざるを得ないと記されている。1t以上の製造/輸入物質には代替法により有害性を同定する。さらに製造量が増えるにつれて、曝露評価まで求められており、動物実験を有効に使っていかねばならない22)。
ただし、新規代替法が開発されても、例えば、経済協力開発機構(OECD:Organisation for Economic Co-operation and Development)テストガイドラインなどに23)、受け入れられるためには10年が掛かると言われており、これまで通りの方法では2017年までには多くの新規試験法を用意できない。新規試験法に求められるものは、化学物質等の安全・安心の確保であり、代替が第一優先ではない。新規試験法の採用においては、各分野の専門家により、適用範囲や再現性、正確性などの視点で慎重に議論されねばならないからである。そこで、類似した試験法については、既存試験法の性能標準(performance standard)に基づいたバリデーションにより、REACHのために“適切な” 方法を短期間で選択するme-tooバリデーションという方策が検討されている23)。
2.2 米国における動向
アメリカにおいては、実験動物はAnimal Welfare Act24)、動物実験はHealth Research Extension Actで規制されている25)。これらを国立科学アカデミー(NAC:National Academy of Sciences)傘下の実験動物研究協会(ILAR:Institute for Laboratory Animal Research)が関係省庁の支援を受けて、実験動物の管理および使用に関する指針を編集し、実験動物および動物実験の倫理・科学的な自主管理を促している26)。以上のような状況は、日本に近い。ただし、その詳細は大きく異なっている。一番大きな相違点は、獣医師の役割である。日本学術会議のガイドラインでは、獣医師の役割は少ないが、ILARの指針では、実験動物を専門とする獣医師が科学と動物福祉の推進役として定められている。また、前述したAAALACの国際認証なども厳しいものであると聞いている。
2.3 国際協調機関
このような動物実験の3Rは欧米主導ということもあり、OECD、世界動物保健機関(OIE:World Organisation for Animal Health)、日米EU医薬品規制調和国際会議(ICH:International Conference on Harmonization of Technical Requirements for Registration of Pharmace uticals for Human Use)、動物用医薬品の承認審査資料の調和に関する国際協力会議(VICH:International Cooperation on Harmonization of Technical Requirements for Registration of Veterinary Products)、化粧品国際規制会議(ICCR:International Cooperationon Cosmetics Regulations)、国際標準化機構(ISO:International Organisation for Standardization)などの規制に関わる国際協調機関においても3Rに関する声明を出している。これらの中で、OECDでは、今後提案されるテストガイドライン案には3Rの精神が盛り込まれることを望んでおり23)、代替法や動物実験でも複数の試験を組み合わせたガイドラインが増えている。OIEの実験動物福祉綱領では、加盟国に実験動物福祉に関する法的整備を勧告している27)。ICHでは、動物実験数削減の可能性もテーマの一つとしてあげられており、in vitro 試験の議論も少しずつではあるが、増えている28)。比較的知名度が低いICCRとは、厚生労働省、米国医薬食品庁(FDA:Food and Drug Administration)、カナダ厚生省(Health Canada)および欧州委員会企業産業総局により2007年9月に設立された化粧品規制のための国際的な協力会議である。その具体的な議題の一つとして、EUの動物実験事情に国際的に対応するため、「化粧品成分の安全性評価と代替法」が挙げられている29)。
2.4 代替法のための国際機関
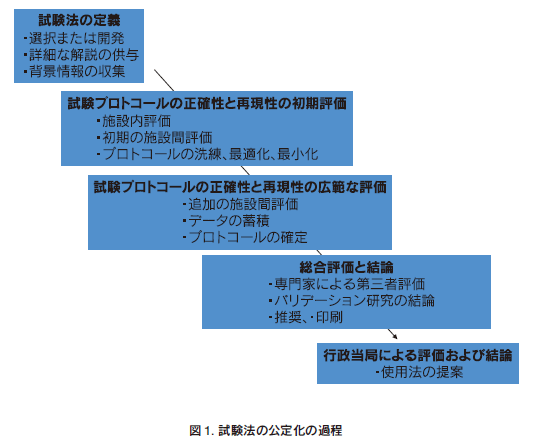
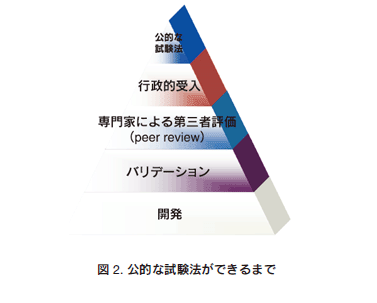
代替法の開発の中で、化学物質等の安全性試験の公定化には厳密な国際ルールが作られている。これが2005年に発行されたOECDガイダンス文書(Guidance Document:GD)No.34である30)。この文書の中には、今後、新規試験法が公定化される場合のバリデーションや第三者評価に関する手順、手法が記載されている。すなわち、図2に示すように31)、新規試験法が公定化されるにはバリデーションや第三者評価、行政的な受入れのための評価を経なければいけない。ところが、図1に示すように、バリデーションや第三者評価を実施すると言っても、正確性や再現性の確認に種々の過程を要する。ましてやバリデーションの実施や実行委員会の構築にはノウハウが多い。第三者評価においても種々の専門家への要請、公的な認証までの手順をも考慮する必要がある。そこで、このガイダンスに先立ち、世界各地にバリデーションセンターが設立された。1990年代に米国ではNICEATM(The National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods)/ ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods)32)、欧州にはECVAMが設立された20)。これらのセンターの役割はそれぞれ法律で規定されており、代替法への関与を粛々と進めている。さらに、遅れて2009年には韓国33)とブラジル34)にもバリデーションセンターが設立された。いよいよ国際的なバリデーションセンター時代の幕開けである。これらセンターの混乱を避ける理由もあり、2009年4月には代替試験法協力国際会議(ICATM:International Cooperation on Alternative Test Methods)が設立され35)、代替法の開発に国際協調の重要性が謳われている。このICATMが設立された理由は、限られた人的・物量的な資源の中、それぞれのセンターが重複した検討を避け、代替法研究を加速することにある。
ただ、欧米のセンターは米国のAlternative Research & Development Foundation 36)
、CAAT(Johns Hopkins Center for Alternatives to Animal Testing)37)やEU内の各国の専門機関FRAME(Fund for the Replacement of Animals in Medical Experiments)38)、NCA (Netherlands Center for Alternatives to animal use)39)、NC3R(UK National Center for the Replacement, Refinement and Reduction of Animals in Research)40)やZEBET(German Center for the Documentation an Evaluation of Alternatives to Animal Experiments)41)、EPAA(European Partnership for Alternative Approaches to Animal Testing)42)というような歴史ある助成機関や代替法専門研究機関を下地にしており、我が国と研究者の層が違うことを認識しておかねばならない。
2.5 代替法に関する欧米の取り組み
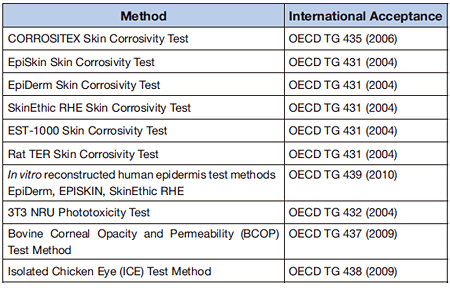
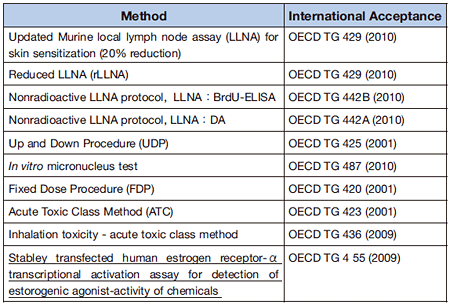
2004年以降、多くの代替法がOECDでテストガイドラインとして認められるようになった。表1に示すように、2001年以降に認められた動物実験の3Rに関する試験法を示す。光毒性試験43)、腐食性試験44-46)などである。
化粧品の規制を考慮に入れ、2008年には、三つの局所刺激性試験のガイドライン案がOECDに提出された23)。一つは培養表皮モデルEPISKINを用いたin vitro 皮膚刺激性試験である。ECVAM科学諮問委員会(ESAC:ECVAM Scientific Advisory Committee)の認証を経て47)、EUからOECDに提出された。さらに、ESACは他の培養表皮モデルEpiDermやSkiEthicsをも認証し48)、これらを合わせ、2010年にテストガイドラインNo.439として承認されている49)。
後の二つは眼刺激性試験代替法BCOP(Bovine Corneal Opacity/Permeability Assay:牛摘出角膜混濁試験)およびICE
(Isolated Chicken Eye Assay:鶏摘出眼球試験)である。いずれも腐食性・強い眼刺激性を検出できる方法としてICCVAMから提案され50)、ECVAMも認証した51)。これら代替法は異例の早さで2009年9月にOECDテストガイドラインとなった52,53)。昨今では、これらの素材に病理学的な評価を組合せ、弱い刺激性を評価しようというガイダンスが検討中である23)。さらに、ECVAMでは眼刺激性試験の代替法として、過去に実施された細胞毒性試験(ニュートラルレッド放出試験、赤血球試験、蛍光物質放出およびマイクロフィジオロメーターの各試験)の回顧的なバリデーションを行い、ESACは2009年7月、蛍光物質放出試験およびマイクロフィジオロメーター試験を限定的な使用で認証した54)。これらの試験法は、OECDテストガイドラインとして検討されることが2010年3月に決まっている23)。なお、次のステップとして、EpiOcular、SkinEthicsなどの培養角膜モデルのバリデーションが進捗中である。
もう一つの開発を急がねばならない代替法である急性毒性試験については、ICCVAMから細胞毒性試験で急性毒性試験の最高適用濃度を定めるという第三者評価報告書55)が2009年、OECDに提案され、2010年にガイダンスとして承認されている56)。
また、in vitro 皮膚感作性試験代替法のプレバリデーションがECVAMで始まった20)。本試験の代替法として、ペプチド結合試験57)および細胞株を用いた試験が挙がっており58-60)、株式会社資生堂および花王株式会社が日本化粧品工業連合会の有志やCOLIPAの協力を得て開発を進めてきたヒト細胞株活性化試験(Human Cell Line Activation Test:h-CLAT)をも含めた検討が、2010年3月に開始された23)。
一方、10年以上前に問題となった環境ホルモンの検出(スクリーニング)を指標としたガイドラインがStably Transfected Human Estrogen Receptor-alpha Transcriptional Activation Assay for Detection of Estrogenic Agonist (STTA)NO.455が2009年に成立し61)、H295R Steroidogenesis Assayの成立が2011年に予定されている23)。
繰り返しになるが、これら試験法の開発を支えているものは、EUや米国における研究資金である。EPAAという政府と産業界が資金を出し合う団体にて、適切な資金・資源の提供を通して、代替法の開発やバリデーションを加速し、安全性評価のための代替法の行政による承認の迅速化を目指している42)。また、動物愛護国際協会(Humane Society International)の支援も貢献度が高い62)。現在でも、これら団体等によりEUでの第7次の研究支援がなされており、さらにAXLR8(accerate)という第三者評価により、研究が推進されている63)。
一方、米国においても、NASは21世紀の毒性試験の中で、“包括的なin vitro試験の利用は、ヒトの生物学に基づいた細胞や分子システムと関連する生物学的挙動を明確にし、最終的には、作用機構を基にしたアプローチにより、動物実験の必要性を排除できるかもしれない”と述べている64)。
また、米国毒性プログラム(NTP:National Toxicology Program)により開発およびバリデートされた試験方法は動物実験の3Rを可能にする。NTPのロードマップの活動と試験法は、規制当局への価値を最大化するため、ICCVAMとの協力および協議を促すと述べている65)。さらに、米国環境省(EPA: Environmental Protection Agency)、米国環境健康科学研究所(NIEHS:National Institutes of Environmental Health Sciences)、米国衛生研究所(NIH:National Institutes of Health)/米国ヒトゲノム研究所(NCGC:NIH Chemical Genomics Center)およびFDAが進めているToxCastというプロジェクトでは65)、化学物質のリスク評価のためのツールとして、ハイスループットシステムを検討している。特に、EPAの戦略では、1)将来の化学物質のスクリーニングや優先順位付けのための毒性経路情報の利用、2)リスク評価における毒性経路情報の利用、3)技術移転を主眼としている。
3.国内の動向-2-
さて、欧米の状況から世界の潮流を理解して頂いたところで、もう一度、国内の動向、特に代替法に特化して説明していきたい。
3.1 日本動物実験代替法学会の動向
日本動物実験代替法学会は67)、設立されて20年を越える世界で初めて設立された代替法に関する学会である。これまで、日本でも眼刺激性、皮膚刺激性、感作性、光毒性試験などの代替法についてバリデーションや第三者評価を行ってきた68)。これらの内容はレベルの高いものであり、欧米での評価は高い。
2007年8月に第6回国際動物実験代替法会議(6th World Congress on Alternatives & Animal Usein the Life Sciences:WC6)69)、2008年2月にWC6フォローアップをいずれも東京で開催し70)、日本国内での盛り上がり以上に日本の活動に対する国際的な評価が高い。大会の内容も世界のトップレベルに近いものであったと感じている。ただし、残念ながら、日本は世界の代替法研究の中心にはいない。よって、その情報は欧米から遠く、高い代替法開発の技術を持ちながら、その技術を利用して、世界のニーズに対応させるという戦略が欠けているようである。
3.2 代替法のための機関
欧米の組織と同様、日本においても置き換えや動物数の削減につながる新規または改良代替法の開発・評価のために、2005年11月に国立医薬品食品衛生研究所安全性生物試験研究センター内に新規試験法評価室が設立された71-74)。この部署の業務の一つが新規または改良試験法の評価という活動である。この活動を我々はJaCVAM(Japanese Center for the Validation of Alternative Methods)と呼んでいる75)。JaCVAMの活動目的は、1)日本における動物実験の3Rの普及、2)国際協調を重視した新規動物実験代替法の公定化である。その試験法検証のための組織を図3に示す。試験法毎にバリデーション、ワーキンググループ、第三者評価の組織を構築し、それらの報告書を受け、行政的な受入れ評価を行い、公定化に支障のない試験法を行政機関に提案している。残念ながら、JaCVAMは欧米のセンターのような法的な裏付けを持たず、永続的な活動ではない。しかし、ICATMの主要メンバーとして国際的な期待および、その評価は高い。これは、日本人の本分野における活躍への期待が大きいからと認識している。具体的に言えば、試験法の開発・改良、バリデーションへの参画は日本人に向いており、現時点では研究者層は薄くとも、代替法研究の加速を期待させるからと感じている。
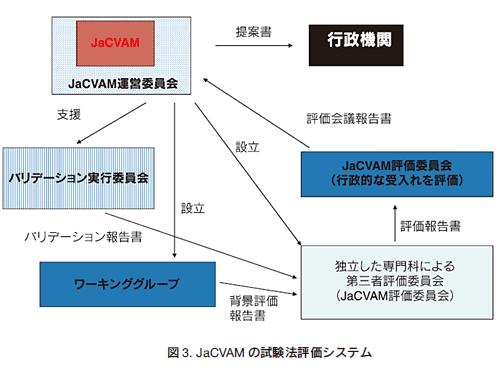
3.3 JaCVAM の活動
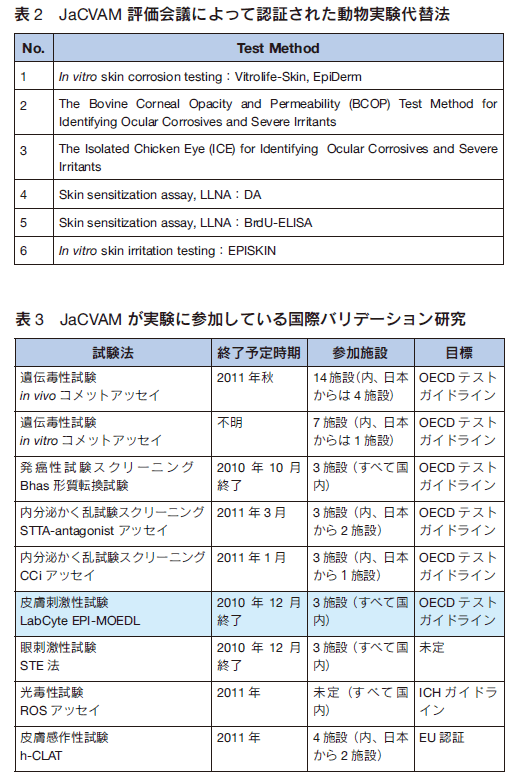
3Rの国際動向に応えるため、JaCVAMでは、眼刺激性、皮膚刺激性、感作性、光毒性試験などの代替法について、日本独自のバリデーションや第三者評価を実施してきた。これまでJaCVAMが承認し、行政に提案した試験法を表2にまとめた。また、現在関与しているバリデーションを表3に記載した。これらの情報はJaCVAMホームページで逐次更新しており、最新情報を入手してほしい75)。以下には昨今、大きな進捗がある安全性試験法を紹介する。
1)腐食性、皮膚刺激性試験
腐食性試験の代替法として、日本製の培養皮膚モデルVitrolife- Skinの正当性をJaCVAM評価会議が認証した76)。
また、皮膚刺激性試験の代替法としてESACにより認証された培養表皮モデルEPISKINについて47)、JaCVAM皮膚刺激性評価委員会がESACの認証内容を確認し、JaCVAM評価会議が認証した77)。一方、日本製の培養表皮モデルLabCyteEPI-MODEL(株式会社J-TEC)については78)、2008-2009年に日本動物実験代替法学会で実施されたバリデーションおよび2010年のJaCVAM主導の追加バリデーションにおいて、EPISKINと同程度の予測性を持つことが検証された。LabCyte EPI-MODELについてはOECDガイドラインへの掲載を目指している。
2)眼刺激性試験
BCOPやICEについても、JaCVAM眼刺激性評価委員会がICCVAMの認証内容を確認し、JaCVAM評価会議が認証した50)。さらに、1998年に厚生労働科学研究補助金を得て作成された「細胞毒性試験による眼刺激性試験代替法のガイダンス」について
79,80)、上記評価委員会にて第三者評価が進行している。また、株式会社花王で開発された細胞毒性試験STE(Short Time Exposure)81)のバリデーションが日本動物実験代替法学会およびJaCVAM主催で実施された。
3)感作性試験
日本が提案したリンパ節中のATP量の変化を指標としたLLNA-DA法82)やBrdUの取り込みを指標としたLLNA-BrdUELISA83)が、JaCVAM評価会議で認証されるとともに84,85)、2010年にOECDテストガイドラインとなった86,87)。一方、前述したように、h-CLAT58,59)のバリデーション研究をECVAMとともに実施している。
4)光毒性試験
活性酸素種(Reactive oxygen species:ROS)を指標とした光毒性試験が光毒性の予測に有用であるとの報告を受け88)、日本製薬工業会の支援を受け、バリデーションを実施している。なお、資生堂株式会社にて酵母・赤血球を用いた光毒性試験の組合せ法は89-91)、JaCVAM評価会議でバリデーション結果が不十分と判断されている92)。
5)遺伝毒性試験
コメットアッセイについては93)、日本環境変異原学会/哺乳類変異原性(MMS)研究会、欧米の研究機関と協力して国際的なバリデーションを進めている。in vivo試験に関しては、最終的なバリデーションの段階にある。in vitro試験に関しては、プロトコルを固めるプレバリデーションの段階にある。
また、イニシエーションに加え、プロモーターも検出できる形質転換試験法 Bhasアッセイについては94)、独立行政法人新エネルギー・産業技術総合開発機構(NEDO)プロジェクトでバリデートされ、OECDにテストガイドラインとしての申請を行っている23)。
6)内分泌かく乱物質スクリーニング
前述したテストガイドラインSTTA法は61)、化学物質評価研究機構(CERI)によって開発された。現在では、このテストガイドラインにアンタゴニストの評価系も加えるべく、バリデーションを実施している。
また、同様にCERIおよび大塚製薬株式会社によって開発されたアンドロゲンの検出試験においても、テストガイドライン案をOECDに提出している23)。
7)急性毒性試験
日本薬局方には、プラスティック容器の品質管理のため、急性毒性試験に代わり、細胞毒性試験を推奨している95)。さらに、ゴム製品の品質管理のために細胞毒性試験の利用を検討している96)。
8)発熱性物質試験
欧州薬局方(European Pharmacopoeia:EP)に掲載された主にヒト血液を用いるin vitro試験に関しては97)、バリデーション結果が不十分と、ICCVAM98)およびJaCVAM評価会議で判断されている99)。
4.終わりに
動物福祉問題イコール、3Rである。ただ、実験動物に携わる方々とお話ししていて感じるのは、3Rを持ち出せば、とりあえず既得権を確保できる、免罪符という発想である。確かに、獣医師もRefinementの面では福祉的な配慮をされているが、削減や置換えの知識やその方策を全くお持ちでないことに愕然とする。上記してきたように、公定な代替法の開発には多額の経費と長い時間が掛かることさえも知らない方が多い。欧米の追随でなく、「動物実験3Rは日本にとって得意芸に近い分野であり、国際的な信用を高め、ビジネスチャンスをつかむ好機である」というように発想を変えて頂きたいものである。欧米の期待を横目で見ながら、手を拱いている時間はない。既存の殻を破るため、皆さんの技術を世界に広めるために、今後もJaCVAM活動に努めてきたいと考えている。
謝辞
バリデーションを進めるにあたり、日本動物実験代替法学会、厚生労働科学研究からの支援に感謝致します。また、試験法の評価に協力頂きましたすべてのJaCVAM関係者に感謝致します。
| 筆者紹介 | |
| 名前 | 小島 肇(ペンネーム:小島 肇夫)Hajime Kojima, Ph. D. |
|---|---|
| 学位 | 学位:薬学博士 |
| 所属・役職 | 国立医薬品食品衛生研究所 安全性生物試験研究センター 薬理部 新規試験法評価室 室長 藤田保健衛生大学 医学部 客員講師 |
| 連絡先 | 〒158-8501 東京都世田谷区上用賀1-18-1 TEL:03-3700-9874 FAX:03-3700-1145 e-mail:h-kojima@nihs.go.jp |
| 生年月日 | 昭和35年4月9日生(50歳) |
| 略歴 | 昭和58年 岐阜大学・農学部農芸科学科卒業 同年日本メナード化粧品株式会社入社 昭和59~ 61年 国立遺伝学研究所・形質遺伝部留学 平成8年 長崎大学薬学部にて博士号取得 平成17年 国立医薬品食品衛生研究所入所 |
| 専門 | 毒性学、変異原性、組織培養 |
| 学会活動 | ・日本動物実験代替法学会 評議員、理事、副会長 ・日本皮膚アレルギー・接触皮膚炎学会 評議員 ・日本環境変異原学会 評議員 ・日本トキシコロジー学会 ・安全性評価研究会 ・日本動物細胞工学会 ・Society of Toxicology |
| 国際協力 | ・ESAC (ECVAM: European Center for the Validation of Alternative Methods Scientific Advisory Committee), observer ・SACATM (Scientific Advisory Committee on Alternative Toxicological Methods, USA), observer ・ICH Center for the Validation Alternative Methods, observer ・ICCR Center for the Validation Alternative Methods, observer ・OECD Endocrine Disrupter Working Group, non-animal, observer ・OECD Test Guideline, National Cordinator |
| 賞罰 | ・日本動物実験代替法学会 1998年論文賞受賞 ・日本動物実験代替法学会 2000年論文賞受賞 ・日本動物実験代替法学会 2003年論文賞受賞 |
| Copyright(c) 1996-2011 DOJINDO LABORATORIES, ALL Rights Reserved. |