 |
| トップページ > 電位感受性色素を用いた脳活動のin vivo 実時間イメージング |
 |
|||||||||||||||
電位感受性色素を用いた脳活動のin vivo 実時間イメージング
|
|||||||||||||||
|
||
|
[Abstract]
Sensory physiology requires the recording of activities of many neurons at the same time. Real time imaging using voltagesensitive dyes has been proved as a powerful technique to this end. We have been using voltage-sensitive fluorescent dyes for the imaging of neural population activity in rodent auditory cortex. Here we first briefly review the technique, stressing on in vivo applications, and then present some of the results obtained in our laboratory. Finally we briefly discuss the pros and cons of the technique and future directions. キーワード:神経活動、多点実時間計測、電位感受性色素 |
||
1.はじめに
脳において神経細胞(ニューロン)同士がシナプスによって連結され、複雑なネットワークを形成している。神経細胞は神経インパルスの時系列を発生させ、それを用いて情報を表現すると考えられている。従って、脳における情報処理の理解はニューロンネットワークの構造と神経インパルスの言葉で説明できることが要求される。しかし、現段階においては、少数例を除いて、脳の大部分、特に大脳皮質に関しては、分かっていない部分が多い。「脳で脳が分かるか」という哲学的な問題を提起し、脳はいつまでも分からないのではないかという主張も存在する。勿論、これは些か短絡過ぎる考えである。我々は脳に対して実験を行うことで調べることができる。実験結果はヒトの思考によらず、脳に潜む物理的化学的な法則を反映するため、いわゆる予想もつかない、つまり我々の脳では考えられない、結果も出たりするので、脳はいずれ分かることになる。このような考え方から、脳研究は演繹的な方法と同じように、帰納的なアプローチが重要であると考えられる。
脳の働きを帰納的なアプローチで探求するために、究極的には、脳の全ての細胞から同時にその活動を計測できることが望ましい。しかし、一個の神経細胞の活動を測ることすら容易でなく、これが脳における情報処理の理解を妨げる一つの大きな要因となっている。個々の神経細胞活動を計測するためには、細くて機械的に強く、化学的に安定で、優れた電気的な特性をもつ電極が必要となる。このような電極を単電極として製作することが可能で、単一細胞活動の計測は現在盛んに行われている。しかし、脳の解剖学的な知見から分かるように、大脳皮質や皮質下の各核も、多くの性質が異なる神経細胞の種類が存在し、複雑なネットワークを構成している。その中で、情報は個々の神経細胞の活動に表現されているだけでなく、細胞間の活動の関係に表現されることも十分考えられるので3)、単電極による単細胞の計測から神経情報処理を議論するには不十分である。従って、脳の全ての細胞から同時にその活動を計測できなくても、できるだけ多くの細胞(細胞集団)から活動を記録することが望まれる。
細胞集団の活動を計測するために、現在幾つかの方法が考えられているが、主に単電極を束にして多電極にする方法と、神経活動の電気信号を光に変換して計測する方法や神経活動による二次的な現象を計測する方法に大別される。本稿では、電位感受性色素を用いて神経活動を蛍光に変換し、実時間で神経活動を多点計測する筆者らの試みを紹介する。この方法自身はかなり以前からCohenらによって開発されており2)、本稿では哺乳類を用いたin
vivo 計測に重点を置く。
2.光計測法の原理
神経細胞に発生する電気信号とは、細胞膜の両側(細胞内と細胞外)に生じる電位差のことで、数mVのシナプス電位と約100mVの活動電位がある。これらの電位を直接計測できれば、最もSN比の良い信号が得られるが、細胞内外の電位差をin vivoで直接計測する方法として、ガラス微小電極を細胞内に刺入して細胞内電位を計測する細胞内記録法がある。しかし、この方法は悪名高いほど難しい。筆者もこの方法を用いて10年近く研究を行った経験を持つが13,15)、その大変さはよく分かる。細胞膜が数nmほどで大変薄いため、シナプス電位や活動電位により、膜内に強い電場が生じる。例えば、100mVの活動電位によって、5nmの細胞膜内に2x107V/mの電場が生じる。これは液晶テレビの液晶にかかる最大電場に同程度のものである。この強い電場の働きにより、膜に人工的に導入した電位感受性色素の蛍光が変化する、或いは色素の吸光度が変化する8)。このような変化を光センサーで計測してやれば、比較的簡単に、間接的に神経活動を計測することができる。そして、センサーアレーを用いれば、一点だけでなく、神経活動を多点から同時にイメージングすることができる。これまで、数千の化合物のスクリーニングから、幾つかの種類の電位感受性色素が見つかっている。これらの多くのものはマイクロ秒のオーダで素早く電位変化に追従し、そして活動電位の範囲内(+100mV 〜 -100mV)で蛍光変化量と膜電位変化量が線形関係にあることが確認されている2, 4)。
3.計測方法
電位感受性色素をin vivoイメージングに応用した場合、色素溶液を脳表に直接加えて神経組織を染色する。染色後に脳表を洗浄し、励起光を与えて蛍光を測定する。神経細胞の電気信号は静止膜電位という直流成分とシナプス電位や活動電位のような“交流成分”に分けられるが、静止膜電位を電位感受性色素で計測することは困難である。蛍光の基線レベル(F)は染色の濃淡や励起光の強さなどで変化するため、静止膜電位との対応関係を割り出すことは困難である。従って、電位感受性色素を用いた計測はシナプス電位や活動電位を反映する蛍光の変化量(ΔF)を測ることになる。一方、ΔFも染色や励起光の強さに依存するため、これらの要素の影響を軽減させるために、ΔF/Fを算出し、シナプス電位や活動電位を反映する信号とする。無論、染色や励起光は計測部位全体において均一にすることが望ましい。
電位感受性色素を用いれば簡単に多点計測できる利点を持つ一方、信号が非常に弱い欠点を持つ。例えば、2000年くらいまで、in vivoで用いられる電位感受性蛍光色素の代表例はRH-795であるが4)、この色素の場合、神経活動に対応する信号として高々0.3%程度の蛍光変化しか得られない。その原因として、電位感受性色素自身の感度の問題もあるが、それ以上にΔFに寄与しないFの成分が存在するためである。in vivoの場合、神経細胞のみならず、柔膜やグリア細胞も染色され、Fに大きく寄与するため、ΔF/Fが微弱な信号となる。従って、計測系の雑音を最大限に抑える必要がある。当然、励起光源に高い安定性も要求され、出力の変化量が1万分の1以下にすることが望ましい。一方、神経活動がサブミリ秒オーダからミリ秒オーダで変化するため、イメージング計測も高いサンプリングレート(1kHz以上) を持つことが要求される。高速でサンプリングすることは短い蓄積時間を意味するので、ショットノイズが目立つようになる。それを軽減させるために、高出力の光源が望ましい。これらの要求から、現在ハロゲン・タングステン光源が主流となっている。 我々は、近年開発された単色光LEDも有効な光源であることを最近示した10)。LEDは音声ノイズを発生させないのみならず、長寿命で省エネ、励起フィルターも必要としない利点も併せ持つため、今後の応用の広がりが期待できる。
電位感受性色素をin vivoに用いた場合、生体に由来するノイズが大きな問題となる。このなかで、特に呼吸によるものと、心拍によるものが、神経活動に由来する信号よりも強く、上手く取り除く必要がある。我々のグループでは、計測時に短時間(1秒以内)呼吸(人工呼吸)を止めることによって呼吸の影響をなくした。心拍のほうは止めるわけにはいかないため、差分法を用いてその影響を除外する。つまり、心電のR波を計測開始のトリガーにして、心拍に同期してイメージング計測を行う。刺激を提示する試行と提示しない試行を交互に繰り返し、その二者の差分から、心拍の影響を取り除いて刺激による反応を分離するのである。これらのことを行うために、人工呼吸器の位相信号と心電図を計測し、イメージング計測のタイミングを決める必要がある。計測系全体の構成は図1に示した。このような方法で、128チャネルのフォトダイオード計測システムを用いて得られたモルモット一次聴覚野の反応を図2に示した。
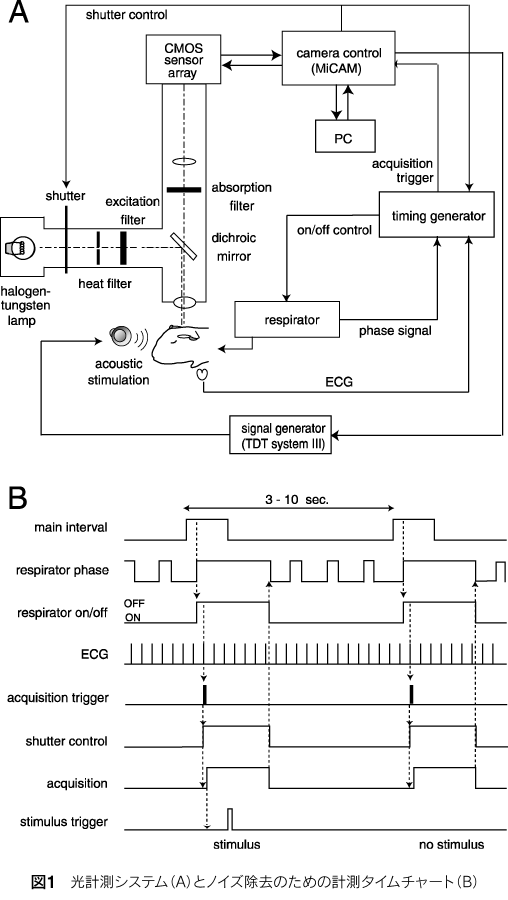
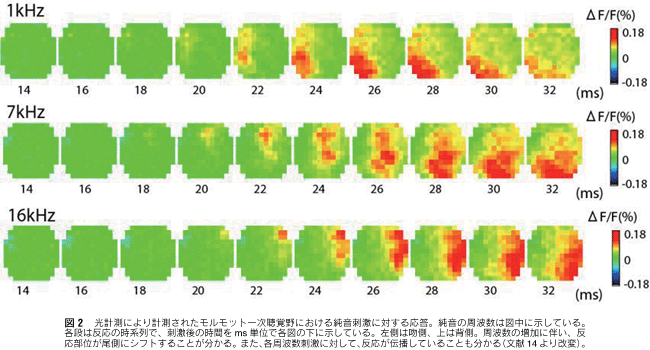
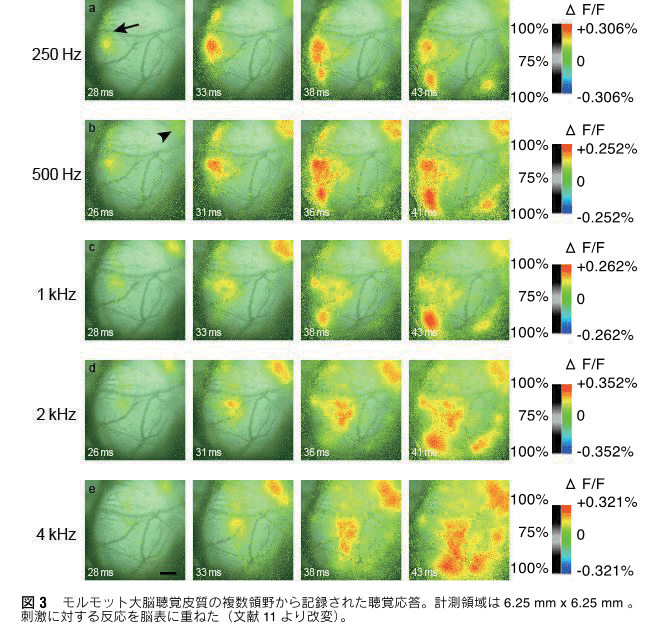
3mm×3mmの部位で1msの時間分解能で得られた反応を16回加算平均したものである。図3には1万チャネルのCMOSセンサーアレーで得られたモルモット聴覚野6.25mm×6.25mmの部位における反応で、同じく1msの時間分解能を持ち、16回加算平均したものである。
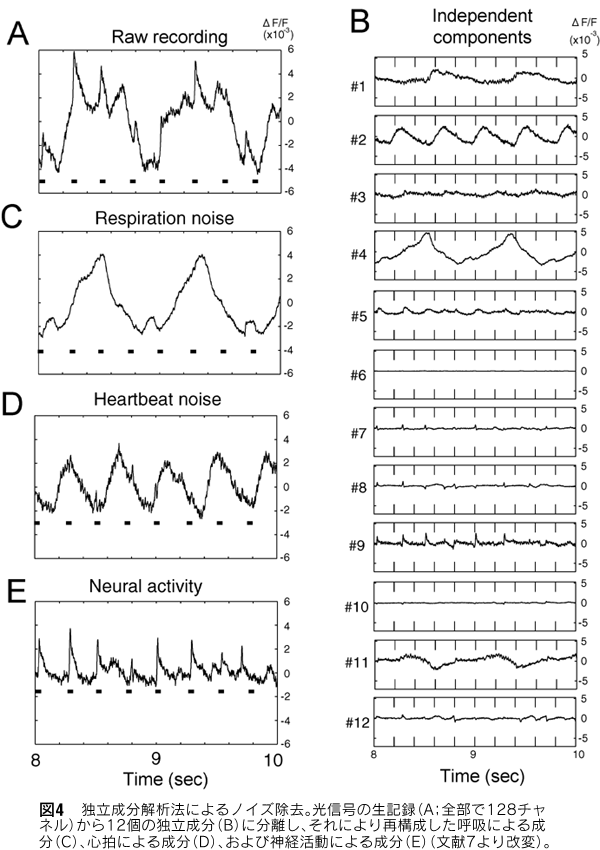
上記のノイズ除去方法は短時間の計測に有効であるが、長時間に亘って計測したい場合、継続して呼吸を止めるわけにはいかないので、他の方法を考える必要がある。一つの選択は露出した脳の部分に密封チャンバーをつけて呼吸によるノイズを抑える方法が考えられる。しかし、これでは心拍の影響が依然残る。それを除去するために、刺激を提示しないで心拍成分の1周期または数周期の平均を求め、それを計測データから差し引く方法が考えられる。この方法は堅実であるが、心拍の周期自体に揺らぎが存在するため、心拍ノイズを完全に除外することはできない。近年、独立成分解析法が考案され、複数の原信号やノイズが混合された形の観測信号のみを用いて、原信号とノイズを分離する方法である6)。これは言わばコックテール・パーティー問題を解く方法の一つであるが、その原理は原信号の間の統計的な独立性を仮定し、反復法により、分離行列で分離した信号間の独立性が最大となるように分離行列を定めるものである。神経活動、呼吸によるノイズ、そして心拍によるノイズの三者は互いに独立と考えられるので、これらの分離に独立成分解析法を適用できると考えられる。実際、大脳皮質聴覚野での計測結果に適用したところ、上手く分離できることが分かった(図4)7)。
これらの方法を用いて、我々はモルモット大脳皮質聴覚野の聴覚応答や自発活動を計測してきた。これまでの聴覚研究により、内耳聴神経はガンマトン・フィルターのようなインパルス応答を持ち、音声情報を時間・周波数分解することが知られている。応答する周波数の高低に従って聴神経線維が蝸牛内において空間的に規則正しく展開されている。このような周波数の空間表現はトノトピーと呼ばれている。光計測法によって、大脳皮質の応答をイメージングすると、大脳皮質の複数の領域において、周波数順に応答部位がシフトし、規則正しいトノトピー構造を示すことが明らかとなった(図2、図3)。また、実時間での計測なので、皮質における活動のダイナミクスもイメージングにより、明らかになり(図2、図3)、その機能的な意義が今後の研究課題として提起された。さらに、聴覚皮質の大規模計測から、これまで報告のなかった皮質聴覚領野の発見にも繋がった11)。
RH-795はモルモットやネコなどに応用できるが、マウスとラットに応用した場合、安定した信号の計測が困難であった。近年、RH-795よりもっと長い励起波長をもつ青の電位感受性色素が二つの研究グループから開発された9,12)。これらの色素はより強い信号を示すとともに、多くの動物や組織に適用できることが示されている。
4.感覚情報の符号化研究への応用
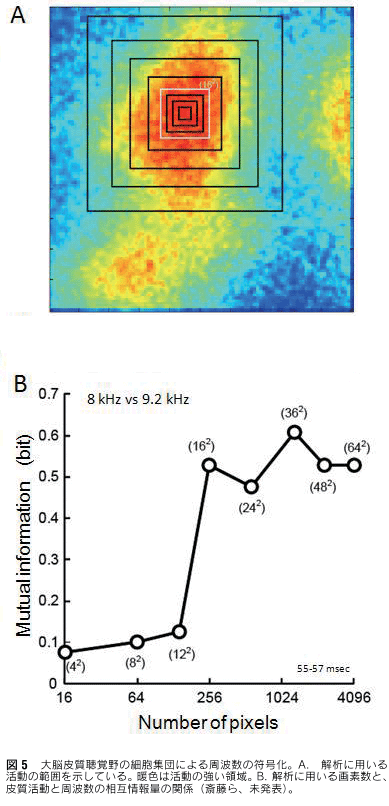
電位感受性色素を用いた研究は、細胞集団の活動を計測できるので、脳の情報処理の解明に応用できると期待されているが、これまで、刺激に対する脳の応答部位の同定に留まっている場合が多い。最近、計測信号のSN比の向上により、光信号を用いて感覚情報の符号化の議論が始まっている1)。聴覚研究の分野において、音の周波数弁別は長い間、神経細胞集団の活動でなければ、行動レベルの結果を説明できないと考えられているが17)、果たして細胞集団の活動によって周波数弁別が個別の細胞の場合に比べて良くなるのか、そして細胞集団の活動によってどれほど周波数弁別が可能であるかについて、実験的な検討が困難であった。これは言うまでもなく細胞集団活動の計測が困難であるためである。我々のグループでは、青の電位感受性色素を用いてモルモット一次聴覚野から、単一試行で応答を計測することができるようになった。これにより、細胞集団活動による周波数弁別について、情報論的なアプローチで検討することが可能になってきた。 周波数が異なる二つの純音の刺激に対する皮質の応答を計測し、その応答から周波数の違いが容易に分かれば、応答に多くの周波数に関する情報を含むことを意味する。図5に示すように、解析に用いる画素の数が多ければ多いほど、つまり解析に用いる細胞の数が多ければ多いほど、皮質の活動により多くの周波数情報を含むことが分かった。つまり周波数情報は細胞集団の活動によって表現されていることを意味する。このように、光計測データを用いて、感覚情報の符号化の議論が可能な段階にきている。今後の研究の展開が期待される。
5. おわりに
本稿では、電位感受性蛍光色素を用いて、大脳皮質活動を実時間でイメージングする方法と、簡単な結果について述べた。実時間イメージングを行うために、高速イメージャーがどうしても必要となるため、これまでイメージング用ハードウェアが高価であった。今後、電子回路技術の発展により、ハードウェアが徐々に入手しやすくなると期待できる。イメージング法で研究を行う際にもう一つ重要なポイントはソフトウェアである。メーカーが付けてくるソフトウェアだけを使用していては、ユニークなことはできない。従って、少なくとも解析ソフトウェアは自作することが望ましい。現在、Matlabに代表されるような初心者にも分かりやすい開発環境が使用できるようになったので、ソフトウェアを自作することもそれほど困難なことでなくなってきている。
現在、電位感受性色素の最大な問題点は細胞選択性がない点である。それにより、SN比が低下し、ある種の神経細胞の活動を選択的に計測しようとしてもできない。これを改善するために、いくつかの研究室においてタンパク性の電位感受性プローブの開発が行われている16)。今のところin vivoに応用できる段階にないが、この方向の研究の発展が大変楽しみである。イメージング法のもう一つの欠点として、組織の深さ方向の情報が得られにくい点である。大脳皮質を例にすると、深さ方向では6つの層からなる層構造を呈しており、層と層の間でどのような情報変換がなされているのかは興味深い問題であるが、イメージング法はこの問題に対して現在無力である。しかし、多電極法や他の計測方法と組み合わせることによって、この問題のある程度の解決が図れる。
我々のグループでは、光イメージング法を大脳皮質の領域同定や音声情報の符号化の研究に応用しているが、ノックアウト動物の解析や神経系や心臓の病態生理の解明など、多くの領域に応用できることは言うまでもない。今後、新しいプローブの開発やイメージングシステムの発展とともに、イメージング技術の応用がますます広がっていくことを期待したい。
謝辞
Loew教授より電位感受性色素をご分与いただいた。ここで述べた仕事は研究室の職員や在籍した大学院生らによるものである。特に、斎藤和也助教、西村方孝君(現在日本学術振興会特別研究員)、前田新一君(現在京都大学助教)、十時慎一朗君(現在島津製作所)らの貢献が大きい。ここで述べた研究は文部科学省特定領域研究および日本学術振興会基盤研究のサポートで行われた。
| 筆者紹介 | |
|---|---|
| 氏名 | 宋文杰(Wen-Jie Song) |
| 連絡先 | 熊本大学大学院生命科学研究部知覚生理学分野 教授 Tel: 096-373-5056 e-mail:song@kumamoto-u.ac.jp |
| 略歴 | 1984年 中国海洋大学卒業 1989年 大阪大学基礎工学部助手 1990年 大阪大学より学位取得後、米国テネシー大学医学部留学 1998年 大阪大学大学院工学研究科准教授 2006年より現職 |
主な研究テーマ |
聴覚生理学と学習の神経機構 |
| Copyright(c) 1996-2010 DOJINDO LABORATORIES,ALL Rights Reserved. |
