 |
| トップページ > 樹状細胞療法と多能性幹細胞 |
 |
|||||||||||||||
樹状細胞療法と多能性幹細胞
|
|||||||||||||||
|
||
|
要約
Dendritic cells (DC) are the most potent antigen-presenting cells and the major regulator cells of immune sytem. Genetically engineered DC expressing antigens and immuno-regulatory molecules are regarded as promising means to manipulate immune responses both positively and negatively. We have established methods to generate DC from mouse and human embryonic stem (ES) cells. Genetic modification of ES cellderived DC (ES-DC) can readily be done by the introduction of expression vectors into undifferentiated ES cells by electroporation and subsequent induction of differentiation of the transfectant ES cell clones to ES-DC. Using mouse models, we have demonstrated the usefulness of genetically modified ES-DC in eliciting anti-cancer immunity and in treating autoimmune disease. Considering future clinical application of this technology, unavailability of human ES cells genetically identical to the patients is a crucial problem. By applying ES-DC technology to iPS cells, we will overcome the issue of histocompatibility and also ethical issues arising from the use of human ES cells. I herein introduce our researches on pluripotent stem cell-derived dendritic cells and discuss the possible clinical application. キーワード:多能性幹細胞、ES細胞、iPS細胞、樹状細胞、免疫療法 がん、自己免疫疾患 |
||
1.はじめに
樹状細胞は、生体内各所に常在する白血球の一種であり、抗原 タンパク質をプロセスしてT細胞に提示する抗原提示機能に特 化した細胞である。感染性微生物の生体への侵入、あるいはワク チンの投与などに際しては、樹状細胞がこのような外来性の異 物(抗原)を捕捉し、リンパ管あるいは血管を経由してリンパ節 や脾臓などのリンパ性組織へ移行する。リンパ性組織において、 樹状細胞は、捕捉した外来抗原中のタンパク質を限定分解し、そ の結果として産生されたオリゴペプチドをMHC(主要組織適合 抗原複合体;ヒトにおいてはHLA)分子との複合体として細胞表 面上へ提示する。一方、T細胞は、血流に乗って全身を巡ってお り、血行性にリンパ性臓器へ到達する。そして、樹状細胞上に提 示された抗原に対する特異的なレセプター(T細胞レセプター、TCR)を有するT細胞が、これを認識し活性化することにより、 抗原特異的な免疫応答、すなわち獲得免疫応答が開始される。樹 状細胞は、このように抗原特異的な免疫応答の賦活化において必 須の役割を担っているが、さらに、自己に対する免疫応答を抑制 する免疫学的自己寛容の維持、あるいは、過剰な免疫応答を抑制 する上でも、重要な役割を果たしていると考えられる。
樹状細胞は、このように免疫応答の制御を担う中心的な細胞で あり、これを用いた細胞療法が検討されている。すなわち、体外 で操作により抗原を付加した、あるいは、機能を修飾した樹状細 胞を投与することにより、生体の免疫応答を人為的に制御する免 疫制御療法である。
我々は、これまでにマウス、サル、およびヒトの多能性幹細胞 から樹状細胞を作製する技術、さらに未分化な状態の多能性幹細 胞において遺伝子改変を行い、これを樹状細胞へ分化誘導することにより 遺伝子改変樹状細胞を作製する技術を開発している。そ して、マウスモデルにおいて、特定の抗原と各種の免疫制御分子 を同時に発現する樹状細胞を作製し、これを投与することにより 個体の免疫応答を抗原特異的に制御するという独自の手法を確立 している。これまでの筆者らの研究のほとんどは、ES細胞を使 用したものであるが、今後は、これまでの成果をiPS細胞へ応用 し、医療技術としての実用化へ向けた研究を進めたいと考えてい る。本稿では、筆者らの研究を中心に多能性幹細胞由来の樹状細 胞を用いる免疫制御療法について紹介する。なお、本稿では、実 験の方法や結果の詳細については割愛させていただいたので、内 容に興味を持たれた方には、参考文献に挙げた原著論文をご参照頂ければ幸いである。
2.がんに対する抗原特異的免疫療法
がんに対する抗原特異的免疫療法は、適切ながん抗原を標的と することにより選択的にがん組織を攻撃することを狙うものであ り、副作用が少なく、かつ効果の高い治療法になりうる可能性を 秘めている。過去十数年来、免疫療法の標的となりうるがん抗原 の同定が精力的に行われてきた結果、数多くのがん抗原が同定さ れているが、そのうちのかなりのものは、細胞表面ではなく細胞 質あるいは核内に存在するタンパク質である。これらのがん抗原 を標的として免疫療法を行うためには、抗原に特異的なT細胞(主 に細胞障害性T細胞)応答を賦活化する必要がある。
現在、これまでに同定された抗原の標的抗原としての有用性を 検討すべく臨床試験が行われている。多くの臨床試験では、細胞 障害性T細胞のエピトープに相当する合成ペプチドを皮下投与 するペプチドワクチンの手法が採られている。細胞障害性T細胞のエピトープとなる8-10アミノ酸残基のオリゴペプチドは、 一般的には安定な化学物質であり、大量合成と精製が容易、比較 的安価、総じて毒性がない等、医薬品として製造・使用する場合 のメリットが大きい。また、多くの臨床試験の結果から、適切な エピトープを選択すれば、人体への投与が許容されている不完全 フロイントアジュバントを用いたペプチドワクチンによる細胞障 害性T細胞の誘導効果は十分に高いことが示されている。一方、 マウスを用いた動物実験において、抗腫瘍効果の誘導という点で は、T細胞刺激細胞である樹状細胞に腫瘍抗原を負荷して投与す る樹状細胞ワクチンにより、さらに高い効果が得られることが認 識されている。
3.抗原特異的免疫抑制法
種々の自己免疫疾患は、様々な自己抗原に対する免疫寛容が破 綻し、免疫系による攻撃により組織傷害が生ずるものである。今 日、多くの自己免疫疾患に対して施行されている免疫抑制剤を用 いた治療では、免疫応答能が全般的に低下する結果、感染症に罹 患する、あるいは悪性腫瘍が発生する危険性が高まるという問題 がある。そこで、免疫応答能全体を低下させず、標的となってい る自己抗原に対する免疫応答のみを特異的に抑制する治療法の開 発が切望されている。
また、腎移植など固形臓器の移植においては、移植後の拒絶反 応が、また、骨髄移植などの造血幹細胞移植においては、移植片 対宿主病(GVHD)の発症が、大きな問題となっている。このよ うな拒絶反応とGVHDは、レシピエントあるいはドナー由来の 免疫細胞のアロ(同種異系)抗原に対する反応が原因で発生する ものである。これを制御するため、移植医療においても免疫抑制 剤の使用が必須であり、これに伴い免疫不全状態が招来される。 この問題を克服し移植医療をより安全かつ成功率の高いものとす るために、アロ抗原に対する免疫応答を特異的に抑制する医療技 術の開発が必要である。
樹状細胞は、免疫応答を抑制的に制御する制御性T細胞 (regulatory T cells)を活性化する能力にも優れている。アロ抗 原を発現する樹状細胞を用いてアロ抗原特異的な制御性T細胞 を活性化するなどして、アロ抗原に対する免疫応答をコントロー ルできる可能性がある。
4.樹状細胞を作製するための材料としての多 能性幹細胞の有用性
現在、臨床的に施行されている樹状細胞療法として、腫瘍抗原 を負荷し生体に移入するがんに対する細胞ワクチン療法がある。 抗腫瘍免疫療法に用いられる樹状細胞は、末梢血白血球中の単球 (モノサイト)をGM-CSF 等のサイトカインを加えて培養し分化 誘導することにより作製されている。しかしながら、末梢血単球は、 体外で増殖させることができないため、樹状細胞治療に必要な数 を得るためには、大量の血液をアフェレーシス(成分採血)処理 することにより得られた白血球中から単球を分離する必要がある。 さらに、単球から樹状細胞への分化誘導効率には細胞ドナーによ り大きな個人差があり、アフェレーシスを行っても必ずしも十分 な数の樹状細胞が得られるとは限らない。このように、末梢血単 球由来の樹状細胞を用いる方法は、ドナーの負担と細胞供給の不 安定性という問題があり、その臨床的有効性が確認されたとして も、医療技術として広く普及するのは困難であると予想される。
ES細胞は、様々な細胞へ分化する能力を備えている代表的な 多能性幹細胞である。ES細胞は、また、旺盛な増殖能力を有しており、 適切な条件の下で培養することにより、多能性を保った まま無限に増殖させることが可能である。筆者らは、無限増殖能 を有するES細胞を材料として樹状細胞を作製することが可能に なれば、細胞ドナーへ負担をかけることなく必要な数の樹状細胞 を作製できるようになると考えた。また、ES細胞は、電気穿孔 法あるいはリポフェクション法により、簡便に遺伝子導入を行う ことが可能であり、さらに、遺伝子導入細胞のクローンを作製す ることも容易である。そこで、ES細胞の段階で遺伝的改変を行い、 適切な遺伝子改変ES細胞クローンを選択し、これを樹状細胞に 分化誘導すれば、樹状細胞の遺伝的改変を容易に行うことができ る。これにより、抗原タンパク質あるいは各種の免疫制御分子を 人為的に発現させるなど、機能を様々に修飾した樹状細胞を作製 することができるという利点もある。
5.マウスES細胞からの樹状細胞への分化誘導
以上のような考えに基づいて、筆者らは、まず、マウスのES細胞から樹状細胞を分化誘導する方法の開発に取り組んだ。マ ウスのES細胞から各種の血液細胞への分化を誘導する方法とし て、OP9細胞(正常なM-CSF遺伝子を欠損したop/opマウスに 由来する骨髄ストローマ細胞株)をフィーダー細胞として用いる 方法が、仲野ら1)により報告されていた。筆者らは、この方法 を参考にして、OP9細胞等のフィーダー細胞と共培養すること により、ES細胞から血液細胞への分化を誘導し、さらに適切な タイミングで樹状細胞への分化を促すサイトカインを加えること により、樹状細胞への分化誘導ができると考え、研究を開始した。 その結果、マウスES細胞から樹状細胞を作製する以下のような 培養プロトコールを確立した(図1)2)。
まず、維持培養中のES細胞をトリプシン/EDTAを用いて回
収し、単層培養しているOP9細胞の上へ播種し、5-6日間培養
する。この結果、ドーム状に盛り上がった形態を示す未分化な
ES細胞のコロニーが、分化した平坦な形態のコロニーへ変化す
る。次に、分化した細胞をトリプシン/EDTAを用いて培養プレー
トから回収し、新たに準備したOP9細胞上でGM-CSFの存在下
で5-6日間培養する。この結果、OP9細胞上に浮遊性あるいは
弱付着性のES細胞の細胞が出現し、GM-CSFに依存して増殖
する。この細胞を細菌培養用のペトリディッシュに移し、さら
にGM-CSFの存在下で培養を続けると3-7日目頃より不規則な
樹状突起を有する浮遊性の細胞が出現する。この細胞は、アロT
細胞を刺激して増殖誘導する活性(MLR刺激活性) を有しており、
また、細胞表面にCD80、CD86、MHCクラス 等を発現していた。
これをさらにTNF-α、IL-4、抗CD40刺激抗体、あるいはLPS等で刺激すると、著明な樹状突起を有し、より強力なT細胞刺
激活性を有する成熟樹状細胞となる。筆者らは、このES細胞由
来の樹状細胞を、ES-DCと名付けた。ES-DCは、GM-CSFに依
存して分化すること、および、表面マーカー(CD11b 陽性) から、
ミエロイド系樹状細胞に相当すると考えられる。
等を発現していた。
これをさらにTNF-α、IL-4、抗CD40刺激抗体、あるいはLPS等で刺激すると、著明な樹状突起を有し、より強力なT細胞刺
激活性を有する成熟樹状細胞となる。筆者らは、このES細胞由
来の樹状細胞を、ES-DCと名付けた。ES-DCは、GM-CSFに依
存して分化すること、および、表面マーカー(CD11b 陽性) から、
ミエロイド系樹状細胞に相当すると考えられる。
6.マウスモデルを用いたES-DCによる免疫制 御療法の有効性の検討
上述した方法で作製した、様々な遺伝的改変を施したマウスの ES-DCを用いて、免疫制御に関する以下のような研究を行った。
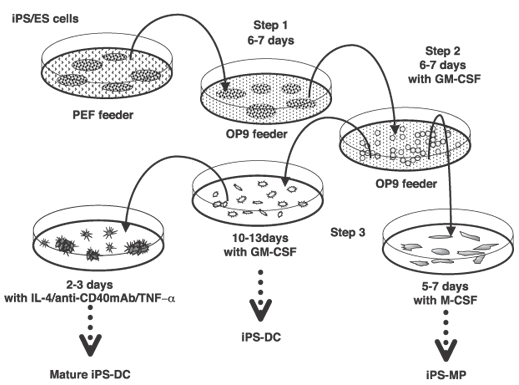
図1.マウスiPS・ES細胞からの樹状細胞への分化誘導
6.1抗原とケモカインを共発現するES-DCを 用いた抗腫瘍免疫効果の増強
ナイーブ(抗原に暴露されていない)T細胞は、リンパ節など のT細胞領域において樹状細胞による抗原提示を受け、エフェ クターT細胞やメモリーT細胞となる。しかしながら、樹状細 胞を体外から投与した場合、リンパ節へ到達するのは投与した樹 状細胞のうちの極一部であり、例えば、樹状細胞を皮下投与した 場合、所属リンパ節へ到達するのは1%以下に過ぎない。したがっ て、体外から移入した樹状細胞のうち、抗原特異的なナイーブ T細胞と遭遇しT細胞を感作するという役目を果たせるものは、 ごく一部であるということになる。
筆者らは、ES-DCにT細胞の遊走を促すケモカインを発現さ せることにより、ES-DCが抗原特異的T細胞を遭遇する効率を 改善し、抗原を負荷した樹状細胞による免疫効果を向上させら れると予想した。生体移入したES-DCがリンパ性臓器へ遊走で きなくても、ES-DCにT細胞の遊走を促すケモカインを強制発 現させておけば、ES-DCが存在する場所へT細胞が集まるので、 抗原特異的なT細胞を活性化する効果を高めることができると 考えたのである。
モデル腫瘍抗原であるオブアルブミン(OVA)の遺伝子を導入 したマウスES細胞に、さらに、T細胞に対する遊走活性を有す るケモカインの遺伝子を導入し、このES細胞からOVAとケモ カインを同時に発現するES-DCを作製した。T細胞の遊走を促 すケモカインとして、生理的に存在する樹状細胞からは産生され ない、SLC(CCL21)、Mig(CXCL9)、およびLymphotactin(XCL1)の3種類を選択した。そして、OVAと各々のケモカインを同時 に発現するES-DCを作製し、これらのES-DCをマウスに投与 した時の免疫効果を比較した3)。
その結果、この3種類のケモカインのいずれについても、OVAを単独で発現するES-DCよりも、OVAとケモカインを同時に発現するES-DCの方が、より効果的にCTLを活性化できることがわかった。 さらに、SLCあるいはMigをOVAと同時に発現するES-DCは、OVA単独発現のES-DCよりも、抗腫瘍効果の誘導 においても優れていた。特にSLCの共発現により、最も強い抗腫瘍免疫の増強効果が得られた。
6.2αガラクトシルセラミド(α-GalCer)を 負荷した抗原発現ES-DCによる抗腫瘍免疫の誘導
NKT細胞は、NK細胞とT細胞の中間的な性質を有する細胞であり、腹腔内、肝臓、肺等に多く存在する。通常のT細胞と同様に抗原レセプターを発現するが、その構造の多様性は非常に限定的であり、非古典的MHCクラス 分子の一種であるCD1d分子上に提示されたα-GalCerなどの脂質抗原をリガンドとして認識する。α-GalCerの刺激を受けたNKTは、IFN-γやIL-4などのサイトカインを大量に産生し、他の免疫細胞を活性化する。樹状細胞にα-GalCerを負荷して投与することにより、NKT細胞によるIFN-γの産生を強力に誘導できることが知られており、α-GalCerを負荷した樹状細胞による抗腫瘍免疫療法の臨床試験も行われている。
分子の一種であるCD1d分子上に提示されたα-GalCerなどの脂質抗原をリガンドとして認識する。α-GalCerの刺激を受けたNKTは、IFN-γやIL-4などのサイトカインを大量に産生し、他の免疫細胞を活性化する。樹状細胞にα-GalCerを負荷して投与することにより、NKT細胞によるIFN-γの産生を強力に誘導できることが知られており、α-GalCerを負荷した樹状細胞による抗腫瘍免疫療法の臨床試験も行われている。
我々は、マウスES-DCも、通常の樹状細胞と同様にα-GalCerを負荷した場合にNKT細胞を活性化することができ ることを見いだした4)。 そこで、腫瘍抗原を発現するES-DCにα-GalCerを負荷して投与することにより、抗原特異的なT細 胞とNKT細胞を同時に活性化し、より強力な抗腫瘍効果が 得られるのではないかと考え実験を行った4)。
OVA抗原を人為的に発現させたマウスメラノーマ細胞MO4を マウス腹腔内に移植し、その3日後にES-DCを投与し、その後 のマウスの生存期間を観察した。その際、投与するES-DCにつ いて、OVA抗原を発現する、あるいは発現しないものに、各々、α-GalCerを負荷した場合と負荷しない場合の合計4通りを比 較した。その結果、α-GalCerを負荷していない抗原を発現しないES-DCを投与した場合に比べて、α-GalCerを負荷したOVA抗原非発現のES-DCあるいはα-GalCerを負荷していない抗原 発現ES-DCを投与した場合、わずかではあるが有意な生存期間 の延長が見られた。一方、α-GalCerを負荷したOVA抗原発現 のES-DCを投与した場合には、著明な生存期間の延長が見られ た。腹膜播種をきたした悪性腫瘍のコントロールは非常に困難で あり、がん治療の臨床医学において解決すべき大きな課題である。 筆者らは、以上の実験結果は、ES-DCによる腹膜播種がんに対 する新たな治療法の可能性を示すものであると考えている。
6.3ES-DCを用いた免疫応答の抑制的制御
ES-DC技術の応用として、自己免疫疾患の標的となる自己抗 原と免疫抑制分子とを同時に発現させたES-DCによる自己免疫 疾患の治療について検討を行った5,6)。EAE(実験的自己免疫性 脳脊髄炎)は、MOG(myelin oligodendrocyte glycoprotein)など ミエリン鞘抗原を強力なアジュバントと混合して動物に投与する ことにより、自己反応性T細胞を活性化することにより誘導さ れる自己免疫疾患のモデルである。このモデル疾患では、中枢神 経系への炎症細胞浸潤と下肢を中心とする運動麻痺が惹起され る。
MOGに由来するペプチドとT細胞応答を抑制する機能を有す るTRAILあるいはPD-L1を共発現するES-DCをマウス個体に 投与することにより、EAEの発症を抑制できるかどうかを検討 した。TRAILとMOGあるいはPD-L1とMOGを発現したES-DCを投与したマウスにおいて、MOGペプチドで誘導されるEAEの抑制が観察された。一方で、無関係な抗原であるOVAとTRAILあるいはOVAとPD-L1を発現したES-DCを投与したマ ウスでは、MOGペプチドによるEAE発症の抑制は認められな かった。さらに、これらのES-DCを投与したマウスにおいて、 外来抗原蛋白(KLH)に対する免疫応答能力には変化がなかった。 以上より、標的自己抗原と免疫抑制分子を同時に発現するES-DCを投与することにより、免疫応答の抗原特異的な抑制的制御 が可能であることが示された。また、この研究において、TRAILを発現するES-DCによるEAE発症抑制効果に制御性T細胞が 関与していることを見いだした6)。
7. ヒトES細胞からのES-DCの作製
ES-DCの臨床応用をめざして、ヒトのES細胞からES-DCを 作製する分化誘導法の開発も行った7)。 造血細胞の分化や増殖 を支持することが知られている複数のストローマ細胞株(OP9、ST2、PA6)をフィーダー細胞として用いて比較した結果、ヒト のES細胞の分化誘導においても、OP9を用いることにより最 も良い結果が得られた。ヒトES-DCの作製においては、マウス の場合と異なり、分化誘導の過程で一時的にGM-CSFに加えてM-CSFを添加することが有効であり、また、フィーダー細胞な しで培養するステップで、GM-CSFに加えてIL-4を添加するこ とが必要であった。ヒトES-DCも、タンパク質抗原をプロセス してT細胞へ提示する活性やアロMLR刺激活性など、樹状細胞 としての機能を備えていた。また、マウスES-DCの場合と同様 の手法で、ヒトの遺伝子改変ES-DCを作製することも可能であっ た。
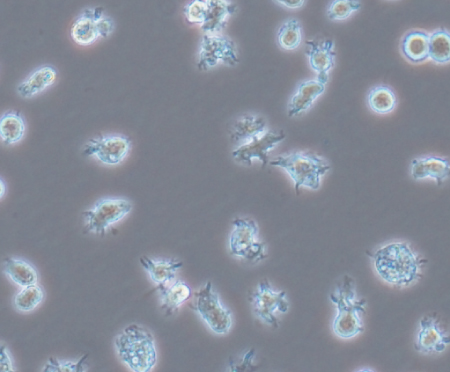
図2.ヒトiPS細胞由来の樹状細胞の形態
8.マウスiPS細胞からの樹状細胞の作製
これまでに我々がES細胞を用いて確立した樹状細胞分化誘導 法を用いて、マウスのiPS細胞から樹状細胞を作製できるのか どうか検討を行った8)。 本研究では、京都大学再生医科学研究所の山中教授らの研究グループに より樹立されたマウスiPS細胞の分与を受け実験に用いた。
ES細胞に近い性質を有しているとされていたNanog-iPS細胞9)を、
マウスのES細胞の場合に準じて分化誘導することを試みた。
その結果、ES細胞の場合とほぼ同様の培養操作により、樹
状細胞を作製することができた。iPS細胞由来の樹状細胞(iPSDC:
iPS cell-derived dendritic cells)は、樹状細胞様の形態を有す
るのみでなく、細胞表面にMHCクラス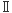 、CD80、CD86を発現
し、また、IL-12とTNF-αを産生した。すなわち、T細胞に対
する抗原提示細胞として必要な分子を発現しており、また、タン
パク質抗原のプロセシング機能を有していた。さらに、樹状細胞
に特徴的な性質とも言える、アロ(同種異系)のT細胞に対す
る非常に強力な増殖反応(一次MLR)誘導活性を有していた。
、CD80、CD86を発現
し、また、IL-12とTNF-αを産生した。すなわち、T細胞に対
する抗原提示細胞として必要な分子を発現しており、また、タン
パク質抗原のプロセシング機能を有していた。さらに、樹状細胞
に特徴的な性質とも言える、アロ(同種異系)のT細胞に対す
る非常に強力な増殖反応(一次MLR)誘導活性を有していた。
以上の分化誘導の過程における形態の変化や最終的に産生され る樹状細胞の機能において、iPS細胞はES細胞とほぼ同等であっ たが、微妙な差異も認められた。iPS細胞は、我々がこれまでに 扱ってきた色々な系統のES細胞株と比較すると、全てのステッ プにおいて分化の速度がやや遅く、最終的に樹状細胞へ分化する までの期間が2割程度長くなる傾向があった。また、ES細胞か らの分化誘導では、分化段階が進んで成熟するにつれ細胞の増殖 能力が低下する、つまり、分化誘導のステップのあとの方になる と細胞があまり増えない傾向があった。ところが、iPS細胞の場 合は、分化段階が進み、成熟した樹状細胞に近い段階でもある程 度の増殖能力を保持している、という違いも認められた。結果的 に、Nanog-iPS細胞からは、マウスES細胞よりも、同じ数の未 分化細胞から分化誘導培養をスタートした場合、より数多くの樹 状細胞を得ることができる、という結果であった。筆者は、この ようなES細胞とiPS細胞の違いは、iPS細胞作製時に導入され た初期化因子(リプログラミングファクター)遺伝子が低いレベ ルで発現することに起因するものと考えている。
我々は、さらに、遺伝子導入により抗原を発現させたiPS-DCによる抗腫瘍細胞ワクチンの実験も行った。まず、未分化なiPS細胞に、モデル抗原であるOVA(ovalbumin:卵白アルブミン)の 発現ベクターを導入した。次に、この抗原遺伝子導入iPS細胞か ら、前述の方法によりiPS-DCを作製した。このOVA抗原発現iPS-DCをマウス個体へ投与すると、マウス体内においてOVA特異的なCTL(細胞傷害性T細胞)が誘導された。そして、OVA抗原発現iPS-DCによる細胞ワクチンを施したマウスは、OVA抗原を発現するメラノーマ(MO4株)に対して拒絶あるいは増 殖抑制効果を示した。すなわち、抗原遺伝子を発現させたiPSDCの投与により、抗原特異的な抗腫瘍免疫応答を惹起すること ができた。
9.おわりに
マウスES細胞からの樹状細胞作製については、筆者らに先ん じて、Fairchildらが、胚様体(Embryoid Body)形成を経由する 方法を報告している10)。 また、ヒトES細胞からの樹状細胞作 製についても、 国外の研究グループから胚様体形成法あるいはOP9細胞を用いるフィーダー共培養が、報告されている11-14)。
最近、ヒトiPS細胞から樹状細胞を含む各種のミエロイド系 細胞を作製できることが、Slukvinらのグループから報告された14)。 筆者らも既に、ヒトのiPS細胞からも機能的な樹状細胞を作 製できことを確認している(未発表:図2)。体細胞から作製で きるiPS細胞の場合は、基礎的な研究の段階においても、また、 臨床応用の段階でも、ES細胞に比べるとその使用に際しての倫 理的問題という障壁がはるかに低い。さらに、iPS細胞は、治療 の対象となる患者自身から作製することが可能である。このため、ES細胞とレシピエントの間の組織不適合性の問題も、ES細胞 のかわりにiPS細胞を使用することによりクリアされる見込みと なった。今後は、ヒトiPS細胞由来の樹状細胞を用いた細胞ワク チンの臨床応用へ向けた動きが出てくるのではないかと予想され る。
ヒトiPS細胞作製法に関連して様々な改良が報告されてはい るものの、現在のiPS細胞作製技術では、一人のドナーからのiPS細胞の樹立に相当な費用と時間を必要とする。従って、治療 対象者全てについての個別のiPS細胞の作製は、医療経済的に成 立しない可能性、また、時間がかかりすぎて治療に必要なタイミ ングで細胞を供給できない可能性がある。このような問題の解決 策として、日本人集団において頻度の高いHLAタイプのホモ接 合体の方々にドナーになっていただいてiPS細胞を作製し“iPS細胞バンク“を設立する、と言う構想15)は非常に有用であると 考えられる。しかしながら、頻度が低いHLAハプロタイプでは、 ホモ接合のドナーが得られない可能性があるので、バンクでのカ バーは難しいかもしれない。
筆者らは最近、マウスES細胞を用いた研究において、MHCクラスI分子の細胞表面の発現に必須の分子であるTAP(transporter associated with antigen processing)あるいはβ2
クログロブリンの遺伝的改変により、分化した後に任意のMHCクラス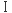 分子のみを発現するES細胞を作製する手法を報告した16)。
頻度が低いHLAハプロタイプについては、ヒトのiPS細胞
にこのような遺伝的改変を施すことにより任意のHLAを発現す
るiPS細胞を作製する、という方法が有効であろう。
分子のみを発現するES細胞を作製する手法を報告した16)。
頻度が低いHLAハプロタイプについては、ヒトのiPS細胞
にこのような遺伝的改変を施すことにより任意のHLAを発現す
るiPS細胞を作製する、という方法が有効であろう。
| 筆者紹介 | |
|---|---|
| 氏名 | 千住 覚(SATORU SENJU) |
| 連絡先 | 熊本大学大学院医学薬学研究部・免疫識別学分野 〒860-8556 熊本市本荘 1-1-1 Tel: 096-373-5313 Fax: 096-373-5314 e-mail:senjusat@gpo.kumamoto-u.ac.jp |
| 経歴 | 1987年 九州大学医学部卒業 1987-1989年 内科臨床研修 1989-1993年 九州大学大学院医学研究科博士課程(生体防御医学研究所・遺伝学部門)卒業 1993-1995年 ワシントン大学ハワードヒューズ医学研究所PD研究員 1995年- 現所属 |
| iPS細胞由来の樹状細胞とマクロファージを用いた疾患治療法の開発 | |
| Copyright(c) 1996-2010 DOJINDO LABORATORIES,ALL Rights Reserved. |
