 |
| トップページ > カルシウムイオン濃度計測法を開発した頃 |
 |
||||||||||||||||||||||||
カルシウムイオン濃度計測法を開発した頃
1.はじめに何年ぶりかで、このニュースに寄稿するチャンスをいただいた。元来、おっちょこちょいである上に気が小さい私は何かを頼まれるといやとは言えない。たいていは二つ返事で引き受けてしまう。今回もそうだ。何を書いてもよいが、できれば、これまでの研究の苦労話をとのことであったので、それなら簡単に書けると瞬時に引き受けたのだ。しかし、私の苦労話など、紙面の無駄だと思われる方も多いだろう。書き始めて、引き受けたことをかなり後悔している。 私の研究人生も40年を超えた。今年は古稀を迎える。この間は苦労の連続であったが、同時に、喜びの連続でもあった。要するに、40年分の記憶としては苦労話か成功話しか残っていないのである。そろそろ、怪しげになってきた記憶力も古いことだと驚くほど鮮明に思い出せる。ひょっとすると自らの記憶の中で適当な脚色をしているのかもしれないが、それなりにドラマチックな研究人生であったと思う。 この機会を使って自己満足をそのまま文章にしてしまえ、同仁化学ニュースならばまさか、ボツにはなるまいと不埒な試みである。若干、冗漫ではあるが、おつきあい願いたい。 2.背水の陣出身大学での教授選に敗れた私はさっさと大学を辞して、三菱化学生命科学研究所に移籍した。ここは研究成果以外に自らの価値を示すことができない場所である。まさに背水の陣と言うべき状況であった。楽天的では人後に落ちない私でもさすがに緊張の日々であった。とはいえ、急に特別なことができるわけもなく、とりあえずは、それまで使ってきたカエルの摘出脊髄標本に電気生理学と薬理学的手法を応用して、当時はホットな話題であった神経伝達物質同定研究を継続することにした。カエル脊髄というとなにやらあまりインパクトがなさそうに見えるが、当時は結構重要な研究対象の一つであり、有名な研究者達がこぞって使っていた標本である。私が使っていた摘出脊髄標本は大阪市立大学、松裏先生からの直伝の脊髄全体を用いる方法であり、世界では松裏先生のグループと私だけしか使っていなかった。大学を飛び出すまでに、すでに 10年近くこの標本を用いて研究発表を続けていたこともあり、その成果を中心とした”The pharmacology of the amphibian spinal cord”と題する総説を発表していたので1)、自分で言うのも口幅ったいが、Frogmanとしてその分野では結構有名と思っていた。自ら作り上げたカリウムイオン電極を武器にして、神経伝達物質候補分子の作用様式を解析していたことや脊髄に骨格筋を取り付けた標本を作り出すなど、まねごとではない独自の研究を展開していたことが孤立無援の私にとって心の支えになっていた2,3)。しかし、研究の世界は自己満足だけで渡りきれるほど甘くはない。移籍してから 4年目を迎えたとき、脳神経科学部に脳神経薬理学研究室が発足し、薬理学研究室の室長から移動することになった。「脳神経薬理学」の看板を掲げるとカエルの脊髄では迫力がない。何とか、これを機会にもっと高等動物の脳研究に発展させたいとあせった。しかし、すぐには方向を見つけることはできなかった。 3.細胞内カルシウムイオン濃度の重要性新しい研究への手がかりはイオン濃度計測法にあった。当時は細胞外の主要なイオンを別のイオンで置きかえるなど、かなり強引に細胞外環境を変えることによって、伝達物質作用のメカニズムを類推するという方法がよく使われていた。私の場合は細胞外カリウムイオンを直接計測していたので、かなり、面白い考察が可能になっていたが、それだけに、ナトリウムイオン、カルシウムイオン、塩素イオンなどの他の重要なイオンの変動についての情報が曖昧で、非常に不満であった。特に、興奮性伝達物質候補であったグルタミン酸の作用が外液のカルシウムイオン濃度の変化や細胞内のカルシウム/カルモジュリン依存性リン酸化酵素の活性を阻害する薬物によって、特徴のある変化を示すことを見いだしていたので、細胞内のカルシウムイオン濃度の計測はいろいろな意味で大きなブレークスルーになるとの確信はあった。もちろん、カリウムイオン電極と同じ方法でカルシウムイオンを計測する電極を作成することはできないわけではない。しかし、細胞内に適用できるほど細い電極を作ることはきわめて困難である。そればかりではなく、細胞に刺入したときに細胞膜に傷ができるとそれだけで、カルシウムイオンは細胞内に流れ込むので、とても信じられない値になってしまうのである。
当時、電極に変わる細胞内カルシウム濃度の計測法がなかったわけではない。2008年度のノーベル化学賞受賞者である下村 脩先生がオワンクラゲから単離した発光タンパク質エクオリンはカルシウムに結合すると発光する性質を持っている。この分子を細胞内に打ち込んで、その発光を計測することで、カルシウム濃度の計測は可能であった。また、アルゼナゾ 4.蛍光カルシウム指示薬の登場ここに登場したのが Quin 2である。下村先生と共に 2008年度のノーベル化学賞を受賞したR.Y.Tsienが合成したものである5)。あまりにも有名な試薬であり、その性質を説明する必要もないが、話の成り行きとしてここに若干の説明を加える。この試薬は細胞外に適用するだけで、細胞内に入り、細胞内カルシウムをキレートする試薬である。分子内の四つのカルボキシル基をすべてアセトキシメチルエステルにしたことで、高い疎水性を持たせて細胞膜透過を容易にした。細胞内に入るとエステラーゼ分解を受けて、細胞内に留まりキレーターとしての性質を発揮する。最初は、細胞に傷をつけることなく、キレ−ターを導入するための試薬として合成されたものであるが、入ったことを確認するために分子の中に組み込んでおいた蛍光ドメインの蛍光量がカルシウム濃度の変化によって変化することが認められ、一躍、注目を浴びることになる。彼らは多量に得られるクローン細胞や血球細胞などに適用した結果を報告した。1982年のことである。Tsienはこの研究で十分にノーベル賞受賞の資格があると思っていたので、GFPでの受賞は意外であった。 5.やっかいな励起波長Tseinの論文を見たとき、これだと思った。すぐに試薬を手配したが、なかなか入手できない。やっと入手して、当時、三菱化学生命科学研究所ではルーチンに使われていた NG108-15と C6Bu-1の二種のクローン細胞を用いて彼らの実験を追試してみた。報告通り、蛍光分光光度計を用いれば容易に計測できる。しかし、これでは面白くない。やはりニューロンのカルシウム濃度を測定したい。実際に機は熟していた。この頃、記憶成立のモデル現象とされる長期増強現象が細胞内カルシウム上昇をきっかけとして生ずるのではないかとの報告があった6)。もちろん、細胞内カルシウム濃度を測っているわけではない。細胞レベルで計測するならば、顕微鏡だ。幸い、当時、研究所には神経細胞の初代培養が確立されており、すぐに海馬のニューロンが入手できた。そこで、Quin 2を負荷して、UV励起で見ると、見事に光っている。なんだこんなに簡単なのかと思った。 しかし、ここからが苦労の始まりであった。この状態ではどんな刺激をしても蛍光の変化は見えないのだ。それもそのはず、この時に使っていた励起光源は水銀ランプであり、蛍光顕微鏡に用いられるスタンダードの紫外励起用 UVカセットには水銀ランプが最も大きな輝度を持つ 365 nm を中心にしたものである。Quin 2の 480 nm の蛍光は 340 nm励起ではカルシウム濃度に依存した上昇が見られるが、380 nm励起では逆に減少する性質を持っている。 使っていた 360 nm はまさに等吸収点(isosbesitic point)でありカルシウムイオン濃度が変わっても全く変化しない波長なのだ。 理由が分かれば簡単だ。340 nm を通せばよい。しかし、水銀ランプのスペクトルを見てがっかりする。出ていないわけではないが、360 nmのほんの裾野であり、バンドパスフィルターを用いてこれを得ることは至難の業である。またまた、幸いに研究所には生物物理学研究室があり、ここでは膜の流動性やアクチンの物性を光学的に計測しているグループがいた。そこに潜り込み、余っていた 500Wのキセノンランプを入手し、ついでにフィルター入手先のアドバイスも受けた。 励起光源を顕微鏡に導く光路にも様々なレンズ系が組み込まれている。これらが、340 nm を吸収してしまう可能性もある。そこで、光路のレンズは一切省いた筒の両端にスリットを取り付けたものを、鉄工所を営んでいる実家の父親に頼んで削りだしてもらった。もちろん、対物レンズも比色計で間違いなく 340 nm が透過することを確認した。いよいよこれで完成と確信した。しかし、これでもまだ 340 nm励起では細胞は全く光らない。途方に暮れた。することがなくなってしまった。顕微鏡メーカーには何度も問い合わせたが、そっけなく「通るはずです」とにべもない回答である。当時、博士研究員として私の片腕になってくれた尾碕君としばらくは放心状態であった。しかし、何か問題があるはずだと気を取り直して、顕微鏡の光路をすべてチェックした。そして、ついに対物レンズのレボルバーに取り付けられたレンズ(凹レンズ)がまったく 340 nm を通さないことを発見した。そこで、このレンズを無理矢理外し、レンズメーカに送りつけて同じレンズを石英で磨いてもらった。一週間ほどで完成したレンズをセットして、励起光をあてると、確かに Quin 2を負荷した細胞が見事に光った。しかも、脱分極刺激を与えると、目にも鮮やかに蛍光量が増大したのだ。感激だった。 6.蛍光変化をどのように計測するかQuin 2はカルシウムイオンを働かなくする目的で作られた試薬であり、そのキレート能(Kd =60 - 80 nM) はほとんど静止レベルの細胞内カルシウムレベルにある。これでは細胞機能に伴うカルシウム変動を観察するための指示薬としてはキレート能が高すぎる。静止状態の細胞のカルシウムイオン濃度よりやや高いところに Kd値を持つ試薬が望ましい。1985年に Tsienは改良型の蛍光カルシウム指示薬として Fura 2と Indo 1を開発した7)。これらの試薬は論文発表前から入手できた。Fura 2はおよそ 200 nMにKdがあり、非常に使いやすい。装置が完成するとほぼ同時にこの試薬が使えたことも幸運であった。 装置の確立に半年以上の時間をかけてしまい、その年の成果らしい成果はない。その上、研究所内では「カルシウムを測定して何の意味がある」とクレームをつける者も出てきた。これ以上遅くなったら、立場はない。しかし、次の大問題が持ち上がってきた。細胞の蛍光をどのようにして計測するかということである。発見者の Tsienらは顕微分光装置を用いて、計測した結果を発表している。これは細胞から発する蛍光を分光器で計測する方法できわめて高価な装置であるが、画像として計測する方法ではない。幸い、装置の開発の途上で、細胞画像のモニターのためにビデオカメラを用いていたので、感度のよいビデオカメラを用いれば、蛍光画像も捉えることができるはずであるとの確信はあった。しかし、当時はビデオカメラについては全く無知な私としては、カタログをひっくり返し、最初は、カルニコンカメラ(残像性はあるものの結構高感度なカメラ)にイメージインテンシファイアーを取り付けた装置を入手した。しかし、すぐに当時としては最も感度が高いSITカメラがあることを知りこれに置き換えた。もちろん、これらのカメラの購入にもいろいろとクレームがついたが、ここまできては後に引けない。そこまでの成果を針小棒大に説明して、予算をもぎ取った。 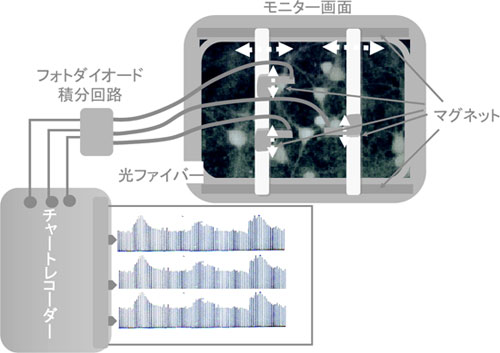
図 1 最初の画像によるカルシウム計測法 Fura 2で染色した細胞の蛍光画像をイメージインテンシファイアーを装着したカルニコンカメラで捉えた。細胞の画像の輝度を光ファイバーで取り出し、フォトダイオードで電位に変換して3チャンネルのチャートレコーダーで計測した。ビデオ画像は 30分の1秒のパルスになるので、簡単な積分回路を介して記録した。 7.ついに完成、初代カルシウム計測装置ともかくFura 2を負荷した神経細胞の蛍光画像をビデオ画像として捉えるところまできた。20倍の対物レンズで見ると、画面一杯にたくさんの光る細胞が映し出される。脱分極刺激をすると、すべての神経細胞の輝度が一気に上昇する。これら細胞一つ一つの反応は個々のデータとして使えるはずである。電気生理学的方法ではたくさんある細胞のうち一つを選んで電極を差し込んで計測することしかできなかったが、この光りの変化を何らかの方法で捉えれば、一網打尽、百個近くの細胞の反応を捉えることができる。そこで、若干強引だとは思ったが、ビデオ画面の輝度を直接測定することにした。その方法は画像解析というには恥ずかしいものであるが、確かに画像からのデータを解析したのだから、画像解析と敢えて言いたい。方法はいかにも原始的だ。まず、プラスチック光ファイバーを入手した。ビデオモニターの画面の上下にシート状のマグネットを固定し、そこに厚さ1mmほどで1cmほどの幅の鉄板を二本くっつけた。この鉄板の上にシート磁石を貼り付けたプラスチック板を置き、それに光ファイバーの先端を固定した。つまり、画面上で光る細胞のある位置に光ファイバーの先端を任意に取り付けられるようにしたのである(図 1)。こうして、引き出される輝度をフォトダイオードで計測した。ビデオ信号であるから、当然、30分の1秒のパルスの列として取り出される。蛍光が上昇すれば、パルスの幅は大きくなる。これを最も簡単に連続信号として捉えるには簡単な積分回路を作ればよい。積分回路などという大仰なものではない、パルスを大きなコンデンサーにため込みその電位を測定するのである。時定数はコンデンサーの容量と貯まった電気を流し出すためにアースとのあいだにはさんだ抵抗の大きさで決まる。こうして、3チャンネルのチャートレコーダーにその出力を記録した。ここまでくれば、きわめて楽に計測できる。重要なことはこれがビデオ画像であるということだ。ビデオテープレコーダーに録画しておけば、残りの細胞からも記録がとれる。まさに今はやりのハイスループットアッセイが可能になったのだ。これは薬理学者としては画期的な方法であると大いに満足した。もっとも、光学の専門家には大いに笑われた。しかし、笑わば笑え、測定できるのだから文句はあるまいと開き直ったものである。 8.グルタミン酸による海馬ニューロンカルシウムイオン濃度の上昇こうして最初に計測したのが、今から考えると不思議なことだが、グリア細胞のクローン細胞C6Bu1細胞であった8)(図 2)。それまでの蛍光分光光度計による実験でセロトニンを適用するとカルシウムが上昇することを確かめていたからである。グリア細胞の活動はこの 5年後からホットな話題になり、現在、重要な研究テーマになっている。 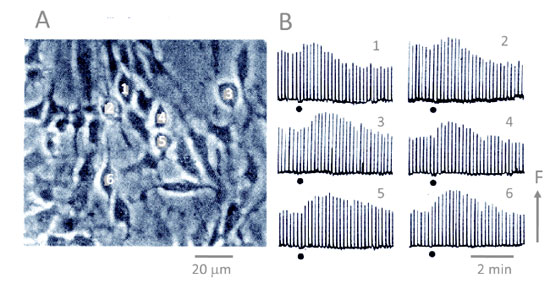
図 2 最初に計測したC6Bu1のカルシウム応答 アストロサイトーマ由来のクローン細胞を Fura 2で染色して、セロトニンを適用すると細胞内カルシウムイオン濃度が上昇する。3チャンネルのレコーダーでリアルタイムに測定した後、ビデオテープに録画した画像から別の細胞の反応を計測することができる。繰り返せば、全細胞の活動を記録できる8)。 そして、ついに海馬ニューロンがグルタミン酸に反応して細胞内カルシウムイオンを上昇させることを明らかにしたのだ。これは紛れもなく世界最初の快挙であった。この成果を1985年に Nature に投稿した。三人のレフリーのうち二人までは絶賛してくれた。しかし、一人のレフリーの執拗なクレーム(ほとんどはピントのずれたものであった)のために、むなしく、リジェクトを食らうことになる。その後、このレフリーの正体を知ることになり、激しい戦いを余儀なくされる。しかし、当時、ビデオカメラで計測する、すなわち、曲がりなりにも画像解析法で計測しようとしていたのは、その男と私たちだけであったから、論文を投稿すれば必ず彼のところにレフリーが回ってゆく。現在のように「この研究者はレフリーから外して欲しい」という要求などできない時代であった。最初の論文は仕方がないから、当時、薬理学者としては最もレベルが高いと考えていたイギリス薬理学会誌に投稿し、一発で受理された。1986年のことである9)。後に多くの研究者から何故 Natureか Scienceに出さなかったのかと問われた。いきさつを話すと、たいてい皆、同じような経験があり、それでも Natureや Scienceに掲載されなければ一流の論文とは見なされない風潮のばかばかしさを嘆きあったものである。 その後、海馬スライス標本への応用10)、培養細胞におけるシナプス形成の検出11)、グルタミン酸受容体チャンネルのカルシウム透過性の特徴12)、そして、現在、私のメインテーマとなっているグリア細胞の活動の検出13)(図 3)、カルシウムイオン濃度の上昇をバイオセンサーとして使う方法14)、飛躍して、麻酔ラット脳に光ファイバーを差し込んで、虚血時のカルシウム上昇を測定する方法15)、そしてさらには新しい蛍光色素を考案して生細胞内でのリン酸化活性をイメージング計測する方法16)など、次々に発表する。ほとんど最初はNatureやScienceに投稿して、激しい戦いの後、拒否された。このような場で愚痴をこぼすのも情けない話であるが、これらはすべて、紛れもなくオリジナルな研究であり、当時、これらの一流論文に発表されていた論文に何の遜色もないものであったと自負している。 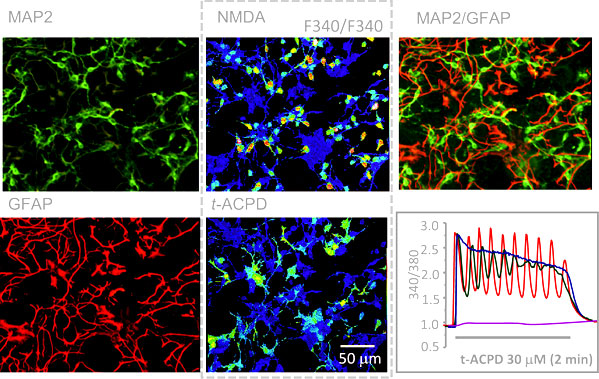
図 3 グリア細胞に発現するグルタミン酸受容体の発見 Fura 2で染色された海馬ニューロンとアストロサイト(グリア細胞)の共培養標本をグルタミン酸受容体作用薬の一つであるNMDA(N-methyl-D-aspartate)で刺激して、反応を画像処理によって計測し、保存する。標本を正常液でよく洗浄した後に、別のタイプのグルタミン酸受容体作用薬t-ACPD (trans-1-aminocyclopentyl-1,3-dicarboxylate)を適用してその反応を画像処理により計測する。その後、細胞を固定処理して、神経細胞認識抗体MAP-2およびアストロサイト認識抗体GFAPを反応させ、それぞれについて蛍光マーカーをつけた二次抗体を反応させた。こうして得られた細胞の像と、先に計測したカルシウムイオン濃度の画像とをつきあわせて、反応細胞の細胞種を同定した。その結果、NMDAに反応した細胞はすべてニューロンであり、t-ACPDに反応した細胞はすべてアストロサイトであったことを確認した13)。 9.喜びの陰に先にも述べたようにカルシウムイオン濃度は様々な生命現象に関わるので、現在では生物科学の分野の必須研究項目になっている。カルシウムイオン濃度解析が現在の画像処理による生命現象解析の先鞭をつけたものであることも間違いない。私の場合には浜松ホトニクスとの出会いがあったから、装置のレベルアップが一気に進んだ。現在、日本でのカルシウム計測法のスタンダードとなっているAquacosmosシステムは、初代の Argus100から発展したものである。このArgus100は、最初に共同研究をした山形大学医学部の加藤教授のグループとともに立ち上げたコンピュータによる計測法のために開発したソフトウエアをベースとしたものである。残念ながら、そのソフトウエアを立ち上げてくれた伊藤憲一先生はすでに故人になってしまった。また、私とともに培養細胞から始まり、海馬スライスの画像、そして光ファイバーによる深部脳細胞カルシウム計測をやってくれた順天堂大学医学部の中村 健先生も若くして亡くなられた。20年以上の歳月には喜びばかりではない事柄も刻み込まれている。また、私の研究を可能にしてくれた三菱化学生命科学研究所も平成21年度で閉鎖されることになっている。寂しい限りである。この研究所には日本各地から、共同研究や装置立ち上げのためのアドバイスを得るために多くの研究者が集った。この研究者達が現在の私の人的財産となっている。この仕事は、研究費の豊富さと人的資源に恵まれた三菱化学生命科学研究所でなければ成し得ない仕事であった。 10.おわりに2008年のノーベル化学賞はGFPの重要性を認めた結果である。 GFPがこれほどまでに広がったのは、それまでに積み上げられてきた画像処理技術に負うところが多い。いまでは画像解析技術は当たり前になっているが、二次元情報のデータ量は圧倒的に大きく、初期のコンピュータやメモリー装置のキャパシティーから考えると無謀と言うべき試みであった。しかし、この20年間のコンピュータと周辺機器、特にメモリー技術の発達は文字通桁外れである。驚くべきスピードでレベルアップが進んだ。おそらく、細胞内カルシウムイオン計測法の開発は私が始めなくても、他の研究者が始めたでことであろう。光技術やコンピュータ関連の知識のある人が始めればもっとスマートに成功したであろう。しかし、むしろ、私のような専門外の人間が始めたことが結果としてよかったのだと考えている。浜松ホトニクス、ニコン、オリンパスなどの光工学機器メーカーに素人の素朴な疑問と要求を突きつけたことが機器メーカーとユーザーの間にあった溝を狭める役割を果たすことになったと信じている。いち早く、Fura 2、Fluo 3、Rhod 2など、質の高い蛍光試薬を入手しやすくしてくれた同仁化学研究所の役割も極めて大きい。この回想文を書く機会を得たことを利用して、これらの関係者に心から感謝の意を表したい。
|
||||||||||||||||||||||||
| Copyright(c) 1996-2009 DOJINDO LABORATORIES,ALL Rights Reserved. |
 を用いて、比色法で測定する方法もあった。しかし、これらは細胞内に何らかの形で刺入しなければない。この操作は細胞に大きなダメージを与える。従って、このダメージに耐えられるくらいの丈夫な細胞にしか適用できない。また、できたとしても、その微弱な光の変化を計測することは難しく、神経系に利用することは容易ではなかった。細胞内カルシウム濃度の変動は神経科学者のみではなく、多くの生物科学分野でも重要性が認められていた。例えば、骨格筋の収縮、心筋の収縮、腺細胞からのホルモンの分泌、受精のシグナル、精子の運動、ほとんどダイナミックな細胞機能にはカルシウムイオンが関与していると予測され、生化学的に立証されていた頃である。また、当時はちょうど神戸大学の西塚泰美先生がプロテインキナーゼ C(PKC)を発見し、G-タンパク質共役型受容体を介した活性化のメカニズムを解明された頃である
を用いて、比色法で測定する方法もあった。しかし、これらは細胞内に何らかの形で刺入しなければない。この操作は細胞に大きなダメージを与える。従って、このダメージに耐えられるくらいの丈夫な細胞にしか適用できない。また、できたとしても、その微弱な光の変化を計測することは難しく、神経系に利用することは容易ではなかった。細胞内カルシウム濃度の変動は神経科学者のみではなく、多くの生物科学分野でも重要性が認められていた。例えば、骨格筋の収縮、心筋の収縮、腺細胞からのホルモンの分泌、受精のシグナル、精子の運動、ほとんどダイナミックな細胞機能にはカルシウムイオンが関与していると予測され、生化学的に立証されていた頃である。また、当時はちょうど神戸大学の西塚泰美先生がプロテインキナーゼ C(PKC)を発見し、G-タンパク質共役型受容体を介した活性化のメカニズムを解明された頃である