 |
| トップページ > 糸状菌とナノテクノロジーが融合した新規血管新生阻害剤 |
 |
糸状菌とナノテクノロジーが融合した新規血管新生阻害剤株式会社同仁化学研究所 平島 義紀 癌とは正常細胞が変異により異常増殖能を獲得する疾患であり、 その由来が自己の細胞であることから、異生物侵入により引き起こされる感染症などに比べ薬物治療による効果を見出すことが困難である。 現在使用されている抗癌剤の多くがこの癌細胞の異常増殖性を選択性としているため、生体内で増殖の盛んな骨髄細胞・粘膜細胞などの正常細胞も障害を受け免疫低下・消化管障害などの重篤な副作用を伴うことが問題となっている。そこで、新たな作用機構を持った抗癌剤が望まれている。また、近年、癌の拡大が血管新生に依存しているという新しい概念が提唱され、この血管新生を標的とした抗癌剤の探索および開発が非常に盛んになってきている。 ここでは、血管新生とその阻害物質について概説するとともに、さらに現在最も注目されている血管新生因子である血管内皮細胞増殖因子(vascular endothelial growth factor:VEGF)に対する阻害物質について極めて強力な経口の血管新生阻害剤であるLodamin(ロダミン)によるモデル実験の研究結果1)も合わせて紹介する。 1.血管新生とは通常の生理的状態では、血管新生はその促進因子と抑制因子によって高度に制御された現象である。しかし、癌(腫瘍)細胞では制御不能の血管新生が見られる。 腫瘍に誘発される血管新生は既存の血管を囲む基底膜が溶解することから始まる。本プロセスは腫瘍細胞や周辺支持組織により作られるマトリクスメタロプロテアーゼ(MMPs)により促進される。続いて血管芽細胞が崩壊した組織細胞外マトリックスを通じて腫瘍細胞へ向けて移動する。そして、細胞外マトリックスの崩壊により血管新生因子の放出が容易になりMMP 活性の増加により腫瘍細胞の転移、血管新生能力が増加する。 現在、腫瘍細胞から産生され、内皮細胞に対する特異性が高く、消化器癌の進展に最も関与しているとされるのがVEGFである。種々の悪性腫瘍において、VEGFが悪性細胞から直接産生されることが報告されており、この事は癌治療の標的因子として、VEGFが利用できることを示唆している。 2.血管新生阻害剤による癌治療血管新生阻害剤は、その標的が血管内皮細胞であり、抗癌剤の様な腫瘍細胞による薬剤感受性の差が無く、また、耐性が獲得される可能性も少ないために固形癌の新しい治療戦略として有望である。 血管新生阻害剤は、特異的に血管新生因子を阻害するものと、非特異的に血管内皮細胞の増殖、浸潤、管腔形成を阻害するものとに大別される。前者の代表がVEGF中和抗体であり、後者の代表が日本で開発されたTNP-470を挙げることが出来る。 TNP-470は、血管内皮細胞の培養中に混入した糸状菌(Aspergillus fumigatus fresenius)が内皮細胞の増殖を阻害したことから偶然発見された低分子物質フマギリン(Fig. 1)を基にして、後述のFolkmanと武田薬品工業がその毒性軽減を目的として、共同開発した合成誘導体である2)。TNP-470は血管内皮細胞の増殖を強く阻害するが、癌細胞に対しては、より高い濃度でないと作用しないという欠点を持っている。作用機構の詳細は不明だが、血管内皮細胞のCDKs(サイクリン依存性キナーゼ)活性阻害による細胞周期の停止と、メチオニンアミノペプチダーゼ阻害活性が報告されている。その血中半減期は5〜10分と極めて短い。 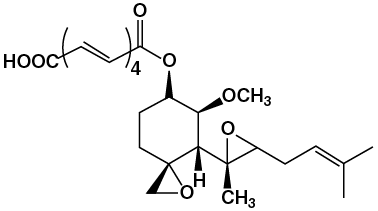
Fig. 1 Fumagillin(フマギリン) 血管新生阻害剤によって癌治療を行った場合、その作用の特徴として、(1)多くの抗癌剤治療の場合に併発する骨髄毒性などの重篤な副作用は起こらないものと考えられる。(2)遺伝子変化が起こりにくいと考えられる血管内皮細胞を標的とするため、癌細胞を標的とした今までの抗癌剤のような獲得薬剤耐性という問題は無いと考えられる。(3)腫瘍血管は、癌の血行性転移にも関与しており、血管新生阻害は転移阻害にも有効であると考えられる。 このように、抗癌剤が癌細胞に直接的(cytotoxic)に作用するのに対して、血管新生阻害剤は、「兵糧攻め」による間接的(cytostatic)な作用であることが大きく異なっている点である。そのため血管新生阻害剤は、既存抗癌剤のように、癌を退縮・消失させることが困難である。従って、血管新生阻害剤による癌治療においては、癌の退縮を期待するのではなく、癌の増殖を抑え、休眠(dormancy)の状態に保つことを期待する治療法として特徴付けられる。血管新生阻害剤は既存抗癌剤と比べて利点が多く、既にアメリカでは数種類の血管新生阻害剤の臨床試験が開始されている。 3.Lodamin (ロダミン) 〜Folkmanらによる抗血管新生の新経口阻害剤〜前述のフマギリン類似化合物であるTNP-470は、“血液供給増加のための血管新生を妨げることによって腫瘍を飢えさせる”というFolkmanの血管新生阻害療法のアイデアによって開発された極めて強力で広域の血管新生阻害剤である。しかし、この薬は脳に作用し、うつやめまいなどの副作用を引きおこした。また、経口での利用能が低く半減期が短いという大きな臨床的制約があり、高頻度で連続的な非経口投与が必要となる。そこで、Folkmanらはその問題解決に取り組み、カプロスタチンの改良薬でナノテクノロジーを合わせ持った初の合成抗血管新生剤であるLodamin(ロダミン)を開発した。 まず、水に溶けにくいTNP-470をモノメトキシポリエチレングリコール−ポリ乳酸ジブロック共重合体に結合させ、この共重合体をナノポリマーミセルに自己組織化させることで、この経口製剤Lodaminを合成した(Fig. 2, Fig. 3)。なお、このポリマーはすでに商業的にも汎用されているものであり、胃酸環境でも保護されるため、経口投与可能なものである。 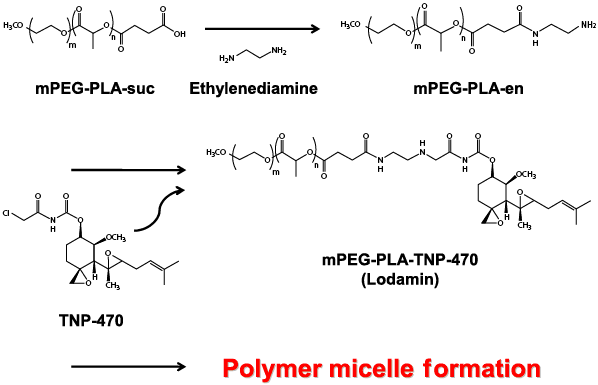
Fig. 2 Synthesis of Lodamin 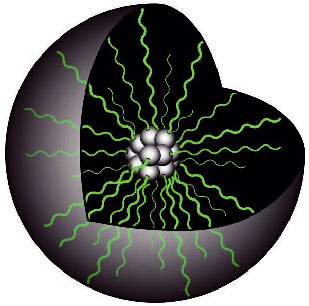
Headline: New Oral Angiogenesis Inhibitor Offers Potential Nontoxic Therapy for a Wide Range of Cancers
Link: http://www.sciencedaily.com/releases/2008/06/080630114209.htm Source: Science Daily / University of Toronto Fig. 3 Polymer Micelle Formation of Lodamin そこで、Lodaminがマウスで腫瘍の増殖を顕著に阻害することを実証するために、培養細胞および腫瘍異種移植片において蛍光色素でラベル化したナノポリマーミセルがエンドサイトーシスによって内皮細胞に取り込まれることを明らかにした。また、血管新生因子である塩基性線維芽細胞増殖因子(basic fibroblast growth factor:bFGF)やVEGFを含有させたペレットをマウス角膜のマイクロポケットに移植して(マイクロポケット法) 3)、輪部血管から生じた新生血管がナノポリマーミセルを処理することによって抑制されるかどうかを検討したところ、血管新生を抑制することを認めた。 そして、遊離型のTNP-470が血液脳関門(blood-brain barrier)を通過するのに対して、ロダミンは脳に浸透しないことから、ロダミンは、TNP-470の効力を保持しているものの、TNP-470が有する神経毒性を示さないこと、ロダミンは半減期が長く、経口投与すると腸で吸収され、最初に肝臓に到達し、選択的に肝臓と腫瘍組織に蓄積して血管新生を阻害することが明らかとなった。 さらに、肝臓に高転移性のマウスメラノーマ細胞(B16/F10)を接種したところ、ロダミンは毒性なく蓄積した。また、マウスの皮下に転移したルイス肺癌細胞とマウス黒色腫細胞の増殖を顕著に阻害し、脾臓に注入したマウス黒色腫細胞の肝転移を有意に抑制して生存期間を延長したことは特筆すべき点であり、同時に、マウスでは特に癌の致命的合併症で適切な治療がない肝転移予防に有効であることを示唆している。他にも目の黄斑に異常が起きて視野の中央が暗く見える、よく見えない、線がゆがむといった症状を有する加齢黄斑変性症の異常血管成長による疾患にも有効であると考えられる。 今後は、薬剤耐性癌細胞の発生にロダミン単独で対処可能なのか、もしくは別の抗血管新生剤との併用が必要なのかを見極めるために、さらに実験を積み重ねる必要があると感じる。 このように、経口での利用能が低いという大きな臨床的制約を克服するために、不溶性のTNP-470をナノポリマーミセルに自己組織化させ、経口投与可能な薬剤とする発想は、汎用性が高く非常に興味深い。医薬品分野のみならず、その応用性は更に広がっていき、様々な分野で利用されることが期待される。 参考文献1) O. Benny, O. Fainaru, A. Adini, F. Cassiola, L. Bazinet, I. Adini, E. Pravda, Y. Nahmias, S. Koirala, G. Corfas, R. J D'Amato and J. Folkman., "An orally delivered small-molecule formulation with antiangiogenic and anticancer activity", Nature Biotechnology, 2008, 26, 799. 2) D. Ingber, T. Fujita, S. Kishimoto, K. Sudo, T. Kanamaru, H. Brem and J. Folkman, "Synthetic analogues of fumagillin that inhibit angiogenesis and suppress tumour growth", Nature, 1990, 348, 555. 3) M. Rogers, A. Birsner and R. D'Amato, "The mouse cornea micropocket angiogenesis assay", Nature Protocols, 2007, 2, 2545. |
| Copyright(c) 1996-2009 DOJINDO LABORATORIES,ALL Rights Reserved. |