エイズから見た感染症研究の最前線
その6 感染細胞からのHIV-1の産生と 型インターフェロン 型インターフェロン
熊本大学大学院医学薬学研究部感染防御学分野 遊佐敬介
|
1. 型インターフェロン防御システムとウイルス感染 型インターフェロン防御システムとウイルス感染
われわれの細胞にあるウイルスに対する代表的な防御システムとして 型インターフェロンがある。この防御システムは長い進化の歴史を通じて、ウイルスと丁々発止の戦いを繰り広げてきた。 型インターフェロンがある。この防御システムは長い進化の歴史を通じて、ウイルスと丁々発止の戦いを繰り広げてきた。 型インターフェロンによって誘導される抗ウイルス作用は多様性に富んでいる。分泌された 型インターフェロンによって誘導される抗ウイルス作用は多様性に富んでいる。分泌された 型インターフェロンは、細胞膜表面のレセプターに結合し、シグナルが細胞内に送り込まれる。これによって惹起される抗ウイルス作用のなかでよく知られているもののひとつは、リン酸化酵素PKRの転写量が上がり、感染したウイルスの二本鎖RNAがPKRを活性化するというイベントだ。活性化されたPKRは、翻訳開始に重要な因子であるeIFαをリン酸化することで細胞の翻訳もろともウイルスタンパク質の翻訳も抑制してしまう。もうひとつの作用は、2-5A合成酵素を活性化し、(2’-5’)オリゴアデニル酸が合成され、これがRNase Lを活性化し、ウイルスのRNAも分解してしまうことだ。感染細胞内のRNAは分解され、翻訳の活性も低下するので、細胞は、一種の耐乏生活に入る。当然ウイルスも複製できなくなる。生命活動を低下させて、侵入者に対処するというのが 型インターフェロンは、細胞膜表面のレセプターに結合し、シグナルが細胞内に送り込まれる。これによって惹起される抗ウイルス作用のなかでよく知られているもののひとつは、リン酸化酵素PKRの転写量が上がり、感染したウイルスの二本鎖RNAがPKRを活性化するというイベントだ。活性化されたPKRは、翻訳開始に重要な因子であるeIFαをリン酸化することで細胞の翻訳もろともウイルスタンパク質の翻訳も抑制してしまう。もうひとつの作用は、2-5A合成酵素を活性化し、(2’-5’)オリゴアデニル酸が合成され、これがRNase Lを活性化し、ウイルスのRNAも分解してしまうことだ。感染細胞内のRNAは分解され、翻訳の活性も低下するので、細胞は、一種の耐乏生活に入る。当然ウイルスも複製できなくなる。生命活動を低下させて、侵入者に対処するというのが 型インターフェロンによる代表的な防御戦略だ。ところが、すでにこうした戦略に対するカウンター兵器を多くのウイルスがもっていることが知られている1)。たとえば、インフルエンザが感染すると宿主のタンパク質p58がhsp40から解離し、PKRに結合して、その活性を抑制するし、アデノウイルスでは、ウイルスの転写産物であるVA RNA 型インターフェロンによる代表的な防御戦略だ。ところが、すでにこうした戦略に対するカウンター兵器を多くのウイルスがもっていることが知られている1)。たとえば、インフルエンザが感染すると宿主のタンパク質p58がhsp40から解離し、PKRに結合して、その活性を抑制するし、アデノウイルスでは、ウイルスの転写産物であるVA RNA がPKRを阻害するばかりでなく、ウイルスタンパク質であるE1AがISGF3をはじめとするインターフェロンによって誘導される遺伝子の転写を抑制する。このほかにもヘルペスウイルス、肝炎ウイルス(HBV)、ポリオウイルス、レオウイルスなど、 がPKRを阻害するばかりでなく、ウイルスタンパク質であるE1AがISGF3をはじめとするインターフェロンによって誘導される遺伝子の転写を抑制する。このほかにもヘルペスウイルス、肝炎ウイルス(HBV)、ポリオウイルス、レオウイルスなど、 型インターフェロンの防御システムを攻撃するウイルスは多い。逆にいえば、それだけ 型インターフェロンの防御システムを攻撃するウイルスは多い。逆にいえば、それだけ 型インターフェロンによる対ウイルス迎撃システムはよく出来ており、ヒトとウイルスの進化における攻防において、一時はウイルスを有効に押さえ込んでいたために、ウイルスはそれに対抗せざるを得なかったのだということができる。 型インターフェロンによる対ウイルス迎撃システムはよく出来ており、ヒトとウイルスの進化における攻防において、一時はウイルスを有効に押さえ込んでいたために、ウイルスはそれに対抗せざるを得なかったのだということができる。
▲ページのトップへ
2.レトロウイルスとヒトの攻防
それではエイズを発症するヒトの代表的なレトロウイルスHIV-1についてはどうであろうか。ヒトとレトロウイルスの攻防にもやはり長い歴史がある。その証拠に、内在性レトロウイルスといういわばかつてヒトが感染したウイルスの残骸がヒトのゲノムにみられることやヒトT細胞白血病ウイルスが、キャリアの体内に潜んで、ヒト成人T細胞白血病(ATL)や神経系疾患(HAM/TSP)などを発症させる例などをあげることができる。ヒトの内在性レトロウイルスHERV-Wのエンベロープタンパク質はいまではヒトの胎盤形成時、生理機能をもった分子として働いていることがわかっている2)。これは、かつてヒトの敵であったウイルスのタンパク質がいまでは宿主側に飼いならされているという驚きの例である。 またサルや類人猿との接触があるアフリカでは、日常的にハンターを中心にサルや類人猿のレトロウイルスが広がっていることが最近わかってきた3)。その多くは直接なんらかの疾患に結びつくことはないにしろ、エイズウイルスの起源が類人猿を宿主としていたレトロウイルスの一種からきたのものであったことを考えると、こうした状況は将来エイズに匹敵するあらたな感染症の出現につながる可能性を否定できない。
宿主がもっているウイルスに対する代表的な防御システムである 型インターフェロンはHIV-1に無力なのだろうか。それとも、HIV-1は、すでに 型インターフェロンはHIV-1に無力なのだろうか。それとも、HIV-1は、すでに 型インターフェロンという防御システムに対する備え、つまり防御システムを無力化する武器を持っているので、ウイルスの感染増殖を防げないのだろうか。前述のようにレトロウイルスはヒトとともに接触感染を繰り返しながら進化してきた。HIV-1はすでに 型インターフェロンという防御システムに対する備え、つまり防御システムを無力化する武器を持っているので、ウイルスの感染増殖を防げないのだろうか。前述のようにレトロウイルスはヒトとともに接触感染を繰り返しながら進化してきた。HIV-1はすでに 型インターフェロン防御システムを無力化する武器を持っていると考えるほうが自然かもしれない。従って、かつてこのシステムが レトロウイルス に有効であった防御効果をみるためには、まず武装解除したHIV-1を人工的につくり、 型インターフェロン防御システムを無力化する武器を持っていると考えるほうが自然かもしれない。従って、かつてこのシステムが レトロウイルス に有効であった防御効果をみるためには、まず武装解除したHIV-1を人工的につくり、 型インターフェロンの影響を調べる必要がある。その実験によってはじめて 型インターフェロンの影響を調べる必要がある。その実験によってはじめて 型インターフェロンがもともともっているレトロウイルス防御システムの実態と、それを無力化したウイルスの進化、両者の攻防の歴史を遡ることが出来る。その歴史をたどる前に、HIV-1が感染細胞からどのようにして産生されるのかをみていこう。 型インターフェロンがもともともっているレトロウイルス防御システムの実態と、それを無力化したウイルスの進化、両者の攻防の歴史を遡ることが出来る。その歴史をたどる前に、HIV-1が感染細胞からどのようにして産生されるのかをみていこう。
▲ページのトップへ
3.感染細胞からのHIV-1粒子の産生
HIV-1のウイルス粒子産生は次のようにして起きる。自分のタンパク質、自分の遺伝情報の書かれたRNAを合成し、それを細胞膜に直下に輸送し、ウイルス粒子形成を行う。この過程の詳細は近年ようやく明らかになってきた。その過程は細胞がもっている小胞形成のシステムを借用することによって起きる4)。じつはこの小胞形成システムは、細胞膜上のタンパク質を分解する一連の過程の一部なのだ。細胞膜上のタンパク質は、エンドサイトーシスによって、細胞内に引き込まれ、初期エンドソームに取り込まれる。やがてその細胞小器官の中に分解されるべき膜タンパク質をのせた小胞が放出される。これを電子顕微鏡でみると、ウイルス並みにちいさな小胞がエンドソームのなかに多くみられる。これをMVB (multivesicular body) と呼んでいる。こののちMVBはタンパク質分解酵素を含む小胞と融合し、MVB中に放出された小胞にのっている膜タンパク質は分解されていく。MBV内への小胞の放出は、MBVの膜の外側に小胞形を成する装置が集まって起きる。この小胞形成システムに参加するタンパク質は少なくとも100種類くらいあり、ESCRT- , ESCRT- , ESCRT- , ESCRT- , ESCRT- とよばれる3つのタンパク質複合体を形成している。HIV-1の細胞からの産生はこの装置を まるごと利用するのである。ウイルスタンパク質Gagが、細胞膜直下にこれら3つのMVB小胞形成装置を呼び寄せて、MVBの中へではなく、細胞膜から外に、ウイルス粒子を放出するのだ。このときウイルスは、細胞外に小胞形成を行わせつつ、自分の遺伝子とウイルス粒子形成に必要な自分自身のタンパク質をすばやく小胞に送り込むのである。 とよばれる3つのタンパク質複合体を形成している。HIV-1の細胞からの産生はこの装置を まるごと利用するのである。ウイルスタンパク質Gagが、細胞膜直下にこれら3つのMVB小胞形成装置を呼び寄せて、MVBの中へではなく、細胞膜から外に、ウイルス粒子を放出するのだ。このときウイルスは、細胞外に小胞形成を行わせつつ、自分の遺伝子とウイルス粒子形成に必要な自分自身のタンパク質をすばやく小胞に送り込むのである。
この過程は、
 ウイルスタンパク質が細胞膜のある場所にあつまる(アッセンブリー) ウイルスタンパク質が細胞膜のある場所にあつまる(アッセンブリー)
 ウイルスタンパク質のGagが 小胞形成装置であるタンパク質複合体 ESCRT- ウイルスタンパク質のGagが 小胞形成装置であるタンパク質複合体 ESCRT- , ESCRT- , ESCRT- を呼び寄せ、ウイルスタンパク質は、自身のエンベロープタンパク質の載った細胞膜を被って小胞となって突出していく(出芽) を呼び寄せ、ウイルスタンパク質は、自身のエンベロープタンパク質の載った細胞膜を被って小胞となって突出していく(出芽)
 粒子形成後、細胞膜と繋がっている膜がくびれ、引き絞られてちぎれる(ピンチオフ) 粒子形成後、細胞膜と繋がっている膜がくびれ、引き絞られてちぎれる(ピンチオフ)
 ウイルス粒子が細胞外に放出される(放出) ウイルス粒子が細胞外に放出される(放出)
という4つにわけて考えることが出来る(Fig.1)。HIV-1感染マクロファージでは、いったんMVB内に出芽・放出されてからそのMVBが、細胞膜と融合する形で、MVB内のウイルスを細胞外に送り出すのではないかといわれてきたが、最近の報告では、マクロファージも細胞表面から直接ウイルスが産生されるものと考えられている。
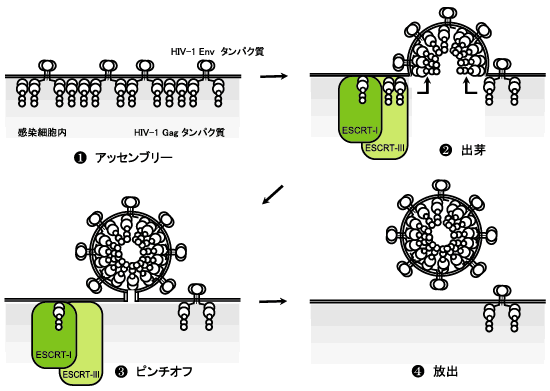 Fig.1 HIV-1の感染細胞からの産生過程
Fig.1 HIV-1の感染細胞からの産生過程
▲ページのトップへ
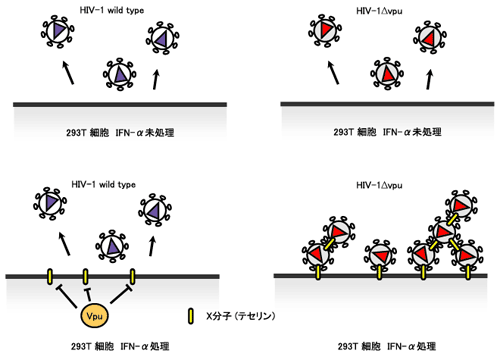
4. 型インターフェロンとHIV-1産生 型インターフェロンとHIV-1産生
以前からインターフェロンαがHIV-1の出芽の阻害に効果があるといわれてきた。しかしその実態はよくわかっていなかった。それはHIV-1が、 型インターフェロン防御システム無力化装置であるVpuタンパク質をもっていたからである。最近、HIV-1 がコードしているvpuという遺伝子を欠損したHIV-1を使って、インターフェロンαの効果が調べられた5)。その結果vpu遺伝子をもたないウイルスはインターフェロンαを細胞に作用させると、複製できなくなることがわかった。それに対してvpuをもつ本来のHIV-1は 型インターフェロン防御システム無力化装置であるVpuタンパク質をもっていたからである。最近、HIV-1 がコードしているvpuという遺伝子を欠損したHIV-1を使って、インターフェロンαの効果が調べられた5)。その結果vpu遺伝子をもたないウイルスはインターフェロンαを細胞に作用させると、複製できなくなることがわかった。それに対してvpuをもつ本来のHIV-1は 型インターフェロンαによる複製抑制効果はみられなかった。インターフェロンαを作用させた感染細胞の表面を電子顕微鏡で見てみると、驚くべきことにウイルス産生が抑制されている細胞表面だけに、ぶどうの房のように成熟したウイルス粒子がお互いくっついたり、細胞表面に吸着した像がみられた。つまり、通常 型インターフェロンαによる複製抑制効果はみられなかった。インターフェロンαを作用させた感染細胞の表面を電子顕微鏡で見てみると、驚くべきことにウイルス産生が抑制されている細胞表面だけに、ぶどうの房のように成熟したウイルス粒子がお互いくっついたり、細胞表面に吸着した像がみられた。つまり、通常 〜 〜 の過程をたどって細胞外でウイルス粒子形成がおきたものの、インターフェロンαの作用によって誘導された細胞の変化の結果、完成したウイルス同士お互い凝集してしまい、細胞表面に固定され、 の過程をたどって細胞外でウイルス粒子形成がおきたものの、インターフェロンαの作用によって誘導された細胞の変化の結果、完成したウイルス同士お互い凝集してしまい、細胞表面に固定され、 ウイルス粒子が放出されるという、4番目の過程がスムーズに行われなくなることがわかったのである。しかもこのウイルス粒子の凝集はタンパク質分解酵素で解消される。この結果から、インターフェロンαによって(おそらく)誘導された膜タンパク質Xが、ウイルスのエンベロープに取り込まれ、ウイルスエンベロープ表面、細胞表面上のそのX分子同士が結合しあって、産生ウイルスのスムーズな放出を妨げているものと推定された(Fig.2)。ウイルス粒子のエンベロープ表面には、様々な細胞由来のタンパク質が取り込まれることがわかっているが6)、インターフェロンαに誘導される分子Xもアンカーのように細胞やウイルス同士をつなぎ止める接着分子のような機能を果たしているものと考えられる。この分子はテセリン(Tetherin:「つなぎとめるもの」の意味)と名付けられているが、その同定が待たれるところである。 ウイルス粒子が放出されるという、4番目の過程がスムーズに行われなくなることがわかったのである。しかもこのウイルス粒子の凝集はタンパク質分解酵素で解消される。この結果から、インターフェロンαによって(おそらく)誘導された膜タンパク質Xが、ウイルスのエンベロープに取り込まれ、ウイルスエンベロープ表面、細胞表面上のそのX分子同士が結合しあって、産生ウイルスのスムーズな放出を妨げているものと推定された(Fig.2)。ウイルス粒子のエンベロープ表面には、様々な細胞由来のタンパク質が取り込まれることがわかっているが6)、インターフェロンαに誘導される分子Xもアンカーのように細胞やウイルス同士をつなぎ止める接着分子のような機能を果たしているものと考えられる。この分子はテセリン(Tetherin:「つなぎとめるもの」の意味)と名付けられているが、その同定が待たれるところである。
このようにじつは 型インターフェロンは立派にその役割(抗ウイルス効果)をはたしているわけなのだが、HIV-1側は、すでにそんなことは先刻承知とばかりに、平気な顔をして増え続けていたのは、すでに 型インターフェロンは立派にその役割(抗ウイルス効果)をはたしているわけなのだが、HIV-1側は、すでにそんなことは先刻承知とばかりに、平気な顔をして増え続けていたのは、すでに 型インターフェロンによる防御システムを打ち破る兵器(Vpu)をもっていたからということになる。Vpuタンパク質がどのようにして 型インターフェロンによる防御システムを打ち破る兵器(Vpu)をもっていたからということになる。Vpuタンパク質がどのようにして 型インターフェロンの抗ウイルス作用を無力化しているかはまだはっきりしていないが、テセリンを分解系に誘導したり、ウイルスエンベロープへのテセリン分子の取り込みを阻害している可能性が考えられる。ウイルスと宿主は進化とともに終わりのない軍備競争をしているということもできる。 型インターフェロンの抗ウイルス作用を無力化しているかはまだはっきりしていないが、テセリンを分解系に誘導したり、ウイルスエンベロープへのテセリン分子の取り込みを阻害している可能性が考えられる。ウイルスと宿主は進化とともに終わりのない軍備競争をしているということもできる。
|
Xタンパク質がIFN-αによって誘導されるが、HIV-1がもつVpuタンパク質によって、その機能が抑制され、ウイルスの放出を抑制できない。
|
Vpuがないために、IFN-αによって誘導されたXタンパク質がウイルス粒子を細胞表面に捉えておくことができる。
|
|
Fig.2 インターフェロンαによるVpu欠損HIV-1粒子放出の阻害
|
▲ページのトップへ
5.おわりに
HIV-1発見当初、このウイルスは断然優勢で、ヒトの免疫システムや 型インターフェロンなどの防御システムをかいくぐって我が世の春を謳歌している一人勝ちの様相を呈していたわけだが、宿主を殺してしまうことはHIV-1にとっても必ずしも得ではない。進化的に見ると、いずれ宿主と穏やかなかたちで折り合っていくものと考えられる。それにはいかに変異を起こしやすいレロトウイルスといえども長い時間がかかる。ここ十数年の化学療法の進歩によって強力な抗ウイルス剤が開発され、ウイルスの封じ込めが成功し始めたのは、HIV-1にとって大きな誤算かもしれない。 型インターフェロンなどの防御システムをかいくぐって我が世の春を謳歌している一人勝ちの様相を呈していたわけだが、宿主を殺してしまうことはHIV-1にとっても必ずしも得ではない。進化的に見ると、いずれ宿主と穏やかなかたちで折り合っていくものと考えられる。それにはいかに変異を起こしやすいレロトウイルスといえども長い時間がかかる。ここ十数年の化学療法の進歩によって強力な抗ウイルス剤が開発され、ウイルスの封じ込めが成功し始めたのは、HIV-1にとって大きな誤算かもしれない。
▲ページのトップへ
参考文献
1) Griffin, “DE Cytokines in viral infection”, Semin. Virol., 1994, 5, 403-463.
2) Wolfe, ND, et al., “Emergence of unique primate T-lymphotropic viruses among central African bushmeat hunters”, Proc. Natl. Acad. Sci. U S A, 2005, 102, 7994-7999.
3) Mi, S, et al, ” Syncytin is a captive retroviral envelope protein involved in human placental morphogenesis”, Nature, 2005, 407, 785-489.
4) Neil, SJ, et al., “An interferon-alpha-induced tethering mechanism inhibits HIV-1 and Ebola virus particle release but is counteracted by the HIV-1 Vpu protein”, Cell & Host Microbe., 2007, 2, 193-203.
5) Neil, SJ, et al., “HIV-1 Vpu promotes release and prevents endocytosis of nascent retrovirus particles from the plasma membrane”, PLoS Pathog., 2006, 2, e39.
6) Monde, K, et al., “Gp120 V3-dependent impairment of R5 HIV-1 infectivity due to virion-incorporated CCR5”, J. Biol. Chem., 2007, 282, 36923-36932.
▲ページのトップへ
▲ページのトップへ
| 

 型インターフェロンなどの防御システムをかいくぐって我が世の春を謳歌している一人勝ちの様相を呈していたわけだが、宿主を殺してしまうことはHIV-1にとっても必ずしも得ではない。進化的に見ると、いずれ宿主と穏やかなかたちで折り合っていくものと考えられる。それにはいかに変異を起こしやすいレロトウイルスといえども長い時間がかかる。ここ十数年の化学療法の進歩によって強力な抗ウイルス剤が開発され、ウイルスの封じ込めが成功し始めたのは、HIV-1にとって大きな誤算かもしれない。
型インターフェロンなどの防御システムをかいくぐって我が世の春を謳歌している一人勝ちの様相を呈していたわけだが、宿主を殺してしまうことはHIV-1にとっても必ずしも得ではない。進化的に見ると、いずれ宿主と穏やかなかたちで折り合っていくものと考えられる。それにはいかに変異を起こしやすいレロトウイルスといえども長い時間がかかる。ここ十数年の化学療法の進歩によって強力な抗ウイルス剤が開発され、ウイルスの封じ込めが成功し始めたのは、HIV-1にとって大きな誤算かもしれない。

 , ESCRT-
, ESCRT- とよばれる3つのタンパク質複合体を形成している。HIV-1の細胞からの産生はこの装置を まるごと利用するのである。ウイルスタンパク質Gagが、細胞膜直下にこれら3つのMVB小胞形成装置を呼び寄せて、MVBの中へではなく、細胞膜から外に、ウイルス粒子を放出するのだ。このときウイルスは、細胞外に小胞形成を行わせつつ、自分の遺伝子とウイルス粒子形成に必要な自分自身のタンパク質をすばやく小胞に送り込むのである。
とよばれる3つのタンパク質複合体を形成している。HIV-1の細胞からの産生はこの装置を まるごと利用するのである。ウイルスタンパク質Gagが、細胞膜直下にこれら3つのMVB小胞形成装置を呼び寄せて、MVBの中へではなく、細胞膜から外に、ウイルス粒子を放出するのだ。このときウイルスは、細胞外に小胞形成を行わせつつ、自分の遺伝子とウイルス粒子形成に必要な自分自身のタンパク質をすばやく小胞に送り込むのである。 ウイルスタンパク質が細胞膜のある場所にあつまる(アッセンブリー)
ウイルスタンパク質が細胞膜のある場所にあつまる(アッセンブリー) ウイルスタンパク質のGagが 小胞形成装置であるタンパク質複合体 ESCRT-
ウイルスタンパク質のGagが 小胞形成装置であるタンパク質複合体 ESCRT- 粒子形成後、細胞膜と繋がっている膜がくびれ、引き絞られてちぎれる(ピンチオフ)
粒子形成後、細胞膜と繋がっている膜がくびれ、引き絞られてちぎれる(ピンチオフ) ウイルス粒子が細胞外に放出される(放出)
ウイルス粒子が細胞外に放出される(放出)