EDTA類似化合物をキレート試薬とする滴定法
金属イオンの分析方法として「キレート滴定」があります。
小社の過去の資料の中から、有用と思われるものをご紹介いたします。
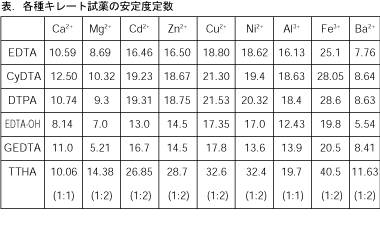
キレート滴定法で用いられるキレート試薬のほとんどがEDTAといって差し支えない。しかし、EDTA以外のキレート試薬の中には、金属イオンに対する安定度定数の値に相当の差異があったり、あるいはTTHAのように安定な1:2キレートを作るものもある。それらのキレート試薬を用いればEDTAでは困難な選択的滴定も可能になる。
EDTA以外のキレート試薬で、主なものは表1の通りである。表に記した安定度定数は溶液のpHおよび補助錯化剤の影響を受けて大きく変動するので、実際にはその他の影響までを含めた、いわゆる"みかけの安定度定数"
が重要な意味を持つ。詳しい理論は別途、専門書をご覧いただきたいが、適当なpHを選び、その安定度の差を利用すれば、EDTAを用いる場合とは異なった組み合わせの混合イオンの選択的分別滴定ができる。
応用
1)GEDTAを用いるCaの選択滴定
表より明らかなようにGEDTAを滴定試薬に用いれば、CaとMgの安定度にΔlogK=11.0-5.2 = 5.8 と他の試薬では見られない差がある。そのため、Mg存在下のCaをpHを変えることなく選択的に定量可能である。Ca、Mgの混合試料溶液を一旦中和し、アンモニア緩衝液でpH10前後とする。指示薬としてはZincon2,3) (0.1 mol/l Zn-GEDTA溶液 1〜2滴を加える。終点の変色は青→赤)、PAN4) (Zn-EDTAを添加、Ca標準液で逆滴定、終点の変色は黄→ピンク)を用いる。
なお、Ca、Mgの混合液にPO43-が共存するとpH6.9以上ではリン酸カルシウムとして沈殿し、滴定ができない。このような場合は、pH6以下で過剰のGEDTAを加えた後、ゆっくりpHを12〜13に上げ、Calceinを指示薬として、Ca標準液で逆滴定する方法がある。
2)GEDTAを用いるMgの選択滴定
EDTAを用いるCa、Mgの混合溶液中のMg定量法は、まずpH10でBTを指示薬とする滴定値 (Ca+Mg) と、pH12 〜13でNNを指示薬とする滴定値 (Caのみ) の差から算出する方法がとられている。このようにMgを直接滴定できないため、Ca、Mgの混合比が大きい場合には誤差が大きくなる。このような場合にGEDTAの安定度定数の差をたくみに利用すればCa、Mg混合物中のMg選択滴定が可能になる。
Ca、Mgの混合溶液にBa-GEDTAを加えると次のような反応が起こることが知られている。
Mg+Ca+Ba-GEDTA+SO42- → Ca-GEDTA+BaSO4↓+Mg
表より、logK (Ca-GEDTA) = 11.0, logK (Ba-GEDTA) =8.4 であるから、Ca、Mgの混合溶液にBa-GEDTAを加えると、CaとBaの交換反応が起こり、同時にBaは添加されているSO42-と反応して難溶性のBaSO4となって沈殿し、試料溶液中にはMgイオンのみが残存することとなる。このMgをBT指示薬を用いEDTAで滴定する。この方法によってCa:Mg = 1:1〜100:1 程度の試料中のMgを少ない誤差で滴定できる。
3)GEDTAまたはDTPAを用いるCd、Znの選択滴定
Cd、Znに対するEDTAのキレート安定度定数は、ほとんど等しいので、EDTAをキレート試薬として用いる限り、Cd、Znは同時に滴定される。GEDTAおよびDTPAの場合も安定度定数の差はほとんどないが、適当なpH条件を選択すれば、みかけの安定度に3〜4の差を生ずることが知られており、光度滴定、電流滴定法を用いればCdのみ定量できる7〜10)。
Ca、Mgの場合と同様にSO42-を加えれば次式のような反応が起こる。
Zn+Cd+Pb-GEDTA+SO42- → Cd-GEDTA+PbSO4↓+Zn
この反応を上手に利用すれば、Znのみ選択的に定量できる。
また、Zn-GEDTAはNaOHアルカリ性溶液中ではGEDTAと亜鉛酸イオンに分解するのに対し、Cd-GEDTAは変化しないので、CdとZn混合試料中のCdを選択的に滴定できる12)。
4)CyDTAを用いるCu, Ni 中のCuの選択滴定13)
CyDTAは、ほとんどの金属に対してEDTAなどより安定度定数が大きい。従ってCyDTAが存在するとKCNと反応しなくなる金属がある (安定度定数が知られていないので比較できないことが多く、同程度の安定度を持っている場合は先に加えたキレート剤と反応する)。CyDTAがあると、NiはKCNと反応しない。この性質を利用してCyDTAを過剰に加えてMg標準液で過剰分のCyDTA量を滴定する。次に30%H2O2約2 ml、KCN約0.5 gを加えるとCuのみCu(CN)42-を生じ、CuとキレートとしていたCyDTAが解離するので、Mg標準液で滴定を続ければCuのみ定量できる。
5)CyDTAを用いるAl,Crの選択滴定14,15)
CyDTAはEDTAよりも反応速度が遅く、滴定に際しては加熱するか、ゆっくりと行う必要がある。特にAl,Cr,Ni,Zrとは反応速度が遅く、0℃ではCrとは数日以上反応しないといわれている。AlとCrの混合試料の場合、Alは常温でCyDTAとゆっくり反応するが、Crは反応しない。従って混合試料にAlに対して常温でCyDTAを過剰加え、一定時間静置後XO指示薬を用いてPb標準液で逆滴定する。滴定の終わった溶液にCrに対してCyDTAを過剰加え、加熱して錯形成させた後、逆滴定を続けるとCrが滴定できる。クロム酸が共存してもこの方法は実施できるが、逆滴定を行うにはZn標準液を用いる必要がある。
6)TTHAを用いる選択滴定16〜18)
EDTA、CyDTA、GEDTAなどいずれも金属と1:1に結合するのが特長である。しかしながらTTHAは金属の種類およびpHを選べば、1:1に結合する場合と1:2に結合する場合がある。例えば、Caは1:1に結合し、Mgは1:2に結合する。従って、Ca+Mg等量混合物をTTHAで滴定すれば、MgはCaに対して半量しかTTHAを必要としないため、EDTAで滴定した場合の1/2 mol/lの滴定値をえる。この差により、Mgの存在量を知ることができる。また、1:2結合する場合、安定度定数が極めて大きくなり、マスキング剤の作用も著しく変化してくる。従ってこのような特殊なキレート試薬は適当に利用すれば、混合イオンの選択滴定に大いに役立つと思われる。
参考文献
1) 上野景平,”キレート滴定法”, 南江堂.
2) F. S. Sadek,R. W. Schmid and C. N. Reilley, Talanta, 1959, 2, 38.
3) E. Wanninen, Talanta, 1961, 8, 355.
4) G. Nakagawa, M. Tanaka and H. Wada, Bull. Chem. Soc. Japan, 1963, 36, 320.
5) J. H. Austin and C. A. Klett, Chemist-Analyst, 1966, 55, 11.
6) R. A. Burg and H. F. Conaghan, Chemist-Analyst, 1960, 49, 100.
7) H. Flaschka and J. Ganchoff, Talanta, 1962, 9, 76.
8) H. Flaschka and J. Butcher, Mikrochim. Ichnoanal. Acta, 1964, 401.
9) D. A. Aikens, G. Schmuckler, F. S. Sadek and C. N. Reilley, Anal. Chem., 1961, 33, 1664.
10) E. Wanninen, Acta Academia Aboensis, Math. Et Phys., 1960, 21, 1.
11) R. Fabregas, A. Prieto and C. Garcia, Chemist-Analyst, 1962, 51, 77.
12) R. Pribil and V. Vesely, Chemist-Analyst, 1966, 55, 4.
13) R. Pribil, Collection, 1955, 20, 162.
14) R. Pribil and V.Vesely, Talanta, 1963, 10, 1287.
15) K. E. Burke and C. M. Sovis, Anal. Chem., 1964, 36, 172.
16) R. Pribil and V. Vesely, Talanta, 1962, 9, 939.
17) 伊藤敦子, 上野景平, 分析化学, 1968, 17, 327.
18) L. Harju and A. Ringbom, Anal. Chim. Acta, 1970, 49, 205.
