
|
�͖�@��O �iMasahiro Kohno�j ���k��w�����Ȋw�Z�p���������Z���^�[ �ʎq���������H�w�n������ |

|
�͖�@��O �iMasahiro Kohno�j ���k��w�����Ȋw�Z�p���������Z���^�[ �ʎq���������H�w�n������ |
�@
[ Summary ]
�@�X�s���g���b�s���O�@�ƘA�������d�q�X�s�������u�iElectron Spin Resonance�FESR�j�͊����_�f�iROSs�j��t���[���W�J���v���̂��߂̍ł����͂Ȏ�i�ł���B����̂�1970�N���獡���܂ŁAESR����͐������W�J�������ɂ����Ď�v�Ȋϑ���i�Ƃ��Ďg���Ă����B�{�e�ł́A���̌v���@���g�������W�J�������ɑ��Ăǂ̂悤�ɉ��p�ł��邩�h�����炽�߂ďЉ��B�����ɁA�V���ȉ��p�W�J�����҂����V�K�X�s���g���b�s���O����ɂ��ďq�ׂ�B
An electron spin resonance spectrometer (ESR) coupled with spin-trapping method is the most powerful tool for observing reactive oxygen species (ROSs) and free radicals. Therefore, from the first stage of 1970s to now, ESR measurement has been used as main equipment for bio-radical research. In the present article, I introduce again to "how to applied for bio-radical?", and spin-trapping reagent which will be expected to new application deployment.
�L�[���[�h�F�����_�f�A�t���[���W�J���AESR�A�X�s���g���b�v��
�@�D�C�������̑����͐����ێ������̂��߂ɑ�ʂ̎_�f������Ă���B���̉ߒ��ɂ����Ď_�f�R���̊����_�f���_�����f(NO�E)�A��_�����f(NO2�E)�Ȃǂ�����B�����̕��q��́A�����ێ��̃��f�B�G�C�^�[�Ƃ��Ă̖�����S���Ă��邪���̂ɏ�Q��^����ꍇ�����萶���Ȋw�̕��L�������̈�ŊS��������Ă���1,2)�B
�@�����_�f�Ƃ́A�_�f����蔽�����̍������q��ł���X�[�p�[�I�L�V�h�i �j�A�ߎ_�����f�iH2O2�j�A�q�h���L�V�����W�J���iHO�E�j�A��d���_�f�i1O2�j�ɕω������ꍇ�̌ď̂ł���B����t���[���W�J���͕s�Γd�q��L���錴�q�܂��͕��q�̂��Ƃ������ANO�E�ANO2�E�A
�j�A�ߎ_�����f�iH2O2�j�A�q�h���L�V�����W�J���iHO�E�j�A��d���_�f�i1O2�j�ɕω������ꍇ�̌ď̂ł���B����t���[���W�J���͕s�Γd�q��L���錴�q�܂��͕��q�̂��Ƃ������ANO�E�ANO2�E�A �AHO�E�Ȃǂ�����B�t���[���W�J���͔������������A�퉷�툳�ł͈���ɑ��݂��鎞�ԁi�����j���Z���Ƃ����������������BH2O2�͔�r�I����ȕ��q��ŁA�y�f�����̊�Ƃ��Ă̓�����_�f�����̖�����S���Ă���t���[���W�J���ł͂Ȃ��B1O2�́A�������͍������s�Γd�q��L���ĂȂ��̂Ńt���[���W
�J���Ƃ͌ĂȂ��B
�AHO�E�Ȃǂ�����B�t���[���W�J���͔������������A�퉷�툳�ł͈���ɑ��݂��鎞�ԁi�����j���Z���Ƃ����������������BH2O2�͔�r�I����ȕ��q��ŁA�y�f�����̊�Ƃ��Ă̓�����_�f�����̖�����S���Ă���t���[���W�J���ł͂Ȃ��B1O2�́A�������͍������s�Γd�q��L���ĂȂ��̂Ńt���[���W
�J���Ƃ͌ĂȂ��B
�@���̓��ɂ��}1�Ɏ����悤�Ȋ����_�f�̐����n�Ə����n���������Ă���B�����_�f�����ł͎����ǃ��x���ł̎������ʂ�ςݏd�˂āA���̏�Q���Ƃ̈��ʊW�𖾂炩�ɂ���w�͂������Ă����B���������̓��Ő������銈���_�f��̓�����ʂ͂Ȃ���Ă��炸�A���_�≼���̈���o�Ă��Ȃ��B�����_�f�̑̓������𖾂炩�ɂ���ɂ́A�ǂ̕��ʂŁA�ǂ̂悤�ȕ��q�킪�A�ǂ̂��炢�̔Z�x(��)��������A�ǂ̂悤�ȍ�p(����)�����Ă���̂����ϑ�����K�v������B���̂��߂ɂ́A�������̍����t���[���W�J����I��I�Ɍv������ʂ�����@�̊m�����s���ł���B
�@��ʓI�Ȋ����_�f����͔����E���F�����p�������w�������͌v��u�����͌v�A�z�������v�ōs���Ă���B�������A�����̌v���ł͔���ٓI�Ȕ����┭�F���ϑ�����邱�Ƃ������A�}1���Ɏ������~�g�R���h���A���̓d�q�`�B�n�A��������NADPH�_���y�f�n�A���Ǔ���זE�̃L�T���`���_���y�f�n�A�̑��g�D��P450�_���y�f�n�Ȃǂ��琶�����銈���_�f�����肵�đ��肷�邱�Ƃ͓���B�B��A�Z�����̃t���[���W�J����I��I����ʓI�ɑ��肷�邱�Ƃ��ł�����@�Ƃ��āAESR-�X�s���g���b�s���O�@����������B�������W�J�������ł͍ł��M�����̍����v����i�ł���Ƃ�����3-6)�B
�@�{�e�ł́A����ESR-�X�s���g���b�s���O�@�ɂ��ďЉ��Ɠ����ɁA�V�������������X�s��-�g���b�s���O����̊J���Ƃ��̉��p���ɂ��ďЉ��B
�@ESR����ɂ͒��ڂƊԐڂ̓�̌v�����@������B���ږ@�͗n�t���̃t���[���W�J�����u�ԓI�ɒቷ�ɂ��A���W�J���������~�����đ��肷����@�ł���B���̂��߁AESR�X�y�N�g�����ϑ������ƃt���[���W�J���̒��ڏؖ��ƂȂ�B���������̕��@�͗n�t��ቷ�ɂ���܂łɃt���[���W�J�������ł��邱�Ƃ������ʐ��Ɍ�����B���̒��ږ@�̌��_��₤�ړI�ōl�Ă��ꂽ�̂��Z�����̃t���[���W�J�����Ԑڌv������X�s���g���b�s���O�@�ł���B�X�s���g���b�s���O�@��1960�N��̌㔼 E. G. Janzen�琔�l�ɂ���Ē�Ă��ꂽ7-11�j�B�{�@�́A�}2�Ɏ������悤�ɃX�s���g���b�s���O�܁i�j�g������������j�g���\�������j�ƃt���[���W�J���iR�E�j�������i�ߑ��ƌĂԁj�A���L�����ɂ���Ĉ���ȃA�~�m�I�L�V�h���W�J���i�X�s���A�_�N�g�ƌĂԁj�������AESR�������u�Ŋϑ�������@�ł���B�X�s���A�_�N�g��ESR�X�y�N�g������͂��邱�Ƃŕߑ����ꂽ�t���[���W�J����̓���ƒ�ʂ��ł���B
�@�t���[���W�J���̓����ESR�X�y�N�g���̉�͂ɂ���čs����B�X�y�N�g���̉�͂́AESR�p�����[�^�ƌĂ��g�l�i�M���̊ϑ�����鎥��̋��x�Ƌ��U���g���Ō��肳���j�ƒ��������萔�iHfcc:a�ŕ\���j�ɂ���čs����BHfcc��ESR�X�y�N�g���̕����\������l�i�p�����[�^�j�ŁA�X�s���A�_�N�g�������X�y�N�g���̕���̎d���ɂ���Č��肳���B���ږ@�Ƃ͈���ăX�s���A�_�N�g�̃X�y�N�g���͒P���ȕ�����������Ƃ�������͂��e�Ղł���B
�@�����ו���iHfS�j���������q�́A���f�iN�j�A���f�iH�j�A�d���f�iD�j�A�����iP�j�Ȃnj����Ă���BHfcc�̓X�y�N�g���̕������������Ă���A����̑傫���͎���̋����imT�j�ŕ\������AaN, aH, aP�Ȃǂƕ\�����B �AHO�E�A�A���R�L�V���W�J���iRO�E�j�A�@�p�[�I�L�V�����W�J���iROO�E�j�A�Y�f���W�J���iC�E�j�Ȃǂ̃X�s���A�_�N�g��Hfcc�l���_���ɂ܂Ƃ߂��Ă���12)�B
�AHO�E�A�A���R�L�V���W�J���iRO�E�j�A�@�p�[�I�L�V�����W�J���iROO�E�j�A�Y�f���W�J���iC�E�j�Ȃǂ̃X�s���A�_�N�g��Hfcc�l���_���ɂ܂Ƃ߂��Ă���12)�B
�@Hfcc��g�l�̑��ɁA�g�`�i�K�E�X�^�A���[�����c�^�j�A�����X�y�N�g���̐��A�����M���̋��x�䂪��͂Ɏg����B
�@�t���[���W�J���̗ʁi�Z�x�j�̓X�s���A�_�N�g��ESR�X�y�N�g���̐ϕ��l�i�ʐρj���狁�߂邱�Ƃ��ł���BESR�X�y�N�g���͔g�`�������`�ł���̂Ŗʐς����߂�ɂ�2��ϕ�������@������Ă���B�ŐV��ESR���u�ɂ͐ϕ��l���X�s�����i�t���[���W�J���̐��A�ʁj�ɕϊ�����v���O��������������Ă���̂ł����p����Ƃ悢�B����Ȋ��m�̃t���[���W�J����W�������Ƃ��ėp���A�X�s���A�_�N�g���狁�߂�ꂽ�ʐς�W�������̖ʐςƔ�r���邱�Ƃɂ���ʂ��ł���B���̕��@�ł́A�X�s���g���b�s���O�܂���������t���[���W�J����100���ߑ����Ă��邱�ƁA�ߑ������X�s���A�_�N�g�̃X�y�N�g��������ł��邱�Ƃ̊m�F���K�v�ƂȂ�B
�@ESR-�X�s���g���b�s���O�@�̓����ɂ��Ă܂Ƃ߂Ă݂��B
�@���_�́A
1�D�X�s���g�A�_�N�g��ESR�X�y�N�g�����ϑ�����邱�Ƃɂ���āA���w�����n���邢�͐��������n�Ƀt���[���W�J�����������Ă��邱�Ƃ��m�F�ł���B
2�D�X�s���A�_�N�g��ESR�X�y�N�g������́ig�l�A���������萔�FHfcc�Aa�l�A���`�A�����j���邱�ƂŁA�t���[���W�J���̓��肪�ł���B
3�D�X�s���A�_�N�g�̖ʐς����ߕW�������Ƃ̔�r�ɂ��A�t���[���W�J���̊Ԑڒ�ʂ��ł���B
4�D�X�s���A�_�N�g�̗ʂ��w�W�Ƃ��đ��x�_�I�ȉ�͂��s���A�t���[���W�J�������ɂ����鐶�����x��������x�����߂���B
����A���_�́A
1�D�g���b�s���O�܂Ɣ�������O�ɁA�t���[���W�J�������킠�邢�͑��̕��q��Ɣ�������ƃX�s���A�_�N�g�������������肪�ł��Ȃ��B
2�D�X�s���A�_�N�g�������ɂ��Z���Ԃŏ������邱�Ƃ�����B
3�D�X�s���A�_�N�g���������ĐV���ȃX�s���A�_�N�g�������A��ʓI�Ȍ덷��������B
4�D�X�s���A�_�N�g��ESR�X�y�N�g��������Ƃ܂钴�������萔�iHfcc�j�́A�X�s���A�_�N�g���q�̋Ǐ��ɂ�����d�q���x�ƍ\���ɊW���Ă��āA�ߑ������t���[���W�J���̕��q���̓d�q���z�╪�q�\���ɊW���钼�ڏ�����Ȃ��B
�Ȃǂł���B
�@ESR-�X�s���g���b�s���O�@���������W�J�������ɖ{�i�I�ɉ��p���ꂽ�̂�1970�N�㔼����ł���13-14�j�B�X�s���g���b�s���O�@�̊J�������ɂ͎���͎s�̂���Ă��Ȃ������̂Ŕ�r�I�������ȒP�ȃj�g�����n��PBN��POBN�Ȃǂ��g���Č������Ȃ��ꂽ�B
�@�}3�ɂ͑�\�I�ȃX�s���g���b�s���O�܂ł���j�g���\�n�ƃj�g�����n�̉������̍\�����������B�j�g�����n����̓X�[�p�[�I�L�V�h��q�h���L�V�����W�J���Ȃǎ_�f���W�J���i�����_�f�j�̌v���ɁA�j�g���\�n�̎���͒Y�f���W�J���A���f���W�J���̑���ɗp������B
�@�������W�J�������ŃX�s���g���b�s���O�܂ɗv�����������Ƃ��āA���ɑ���n��x���������ƁA�n����Ɏ�����ł��邱�ƁA�ߑ����郉�W�J�����q�ւ̑I�𐫂��������ƂȂǂ���������B�������ɂ��Ă͌��������p�r�ɂ���ĈقȂ��Ă���B�Ⴆ�A�t���[���W�J���̐����ߒ��𑨂���ɂ͔��������������Ƃ��]�܂�A����A���������̑���ł͔��������Ⴂ���Ƃ��v�������B����ɁA�X�s���A�_�N�g�̎����������AESR�X�y�N�g����͂��e�Ղł��邱�Ƃ����z�I�ȃX�s���g���b�s���O�܂̏����ƂȂ�B
�@�������W�J�������Ŏg�����\�I�ȃX�s���g���b�s���O�܂�5,5-dimethyl-1-pyrroline-N-oxide(DMPO)�ł���BDMPO�����p����Ă��闝�R�́A�����_�f�R����DMPO �̃X�s���A�_�N�g��ESR�X�y�N�g���̉�͂��e�Ղł������A�����x�̎���
�����m���w�������� �J���������I�ɋ������ꂽ�A���S�҂��e�ՂɈ������ȂǗ�����������Ă������Ƃɂ��B�������ADMPO�����\�ł͂Ȃ��A����̈��萫��2�������Ȃnjv����̖�������Ă���B���̂��߁A�V�K�̃X�s���g���b�s���O����J���̊��҂͑傫���B��ŏЉ��V�K����͐������W�J�������̉��p�ɗL�]�ł��邪�A����̓������悭�������A�����̎�Z���n�m���ĂȂ���Ȃ�Ȃ����Ƃ͏]���Ɠ��l�ł���B
�@���̃��W�J����̓���ɏ��������ɂ�鋣���������g���čs���邱�Ƃ�����B�}4�̏�i�̓L�T���`���_���y�f�n�Ő�������A �̃X�s���A�_�N�gDMPO-OOH�̐M���ł���BESR�p�����[�^�ɂ���ē��肪�s���邪�A�����w�I�ɂ̓X�[�p�[�I�L�V�h�W�X���^�[�[�iSOD�j���n�ɓY�����ASOD�Z�x�Ɉˑ�����ESR�X�y�N�g�����x�̌����ׁA�X�s���A�_�N�g��
�̃X�s���A�_�N�gDMPO-OOH�̐M���ł���BESR�p�����[�^�ɂ���ē��肪�s���邪�A�����w�I�ɂ̓X�[�p�[�I�L�V�h�W�X���^�[�[�iSOD�j���n�ɓY�����ASOD�Z�x�Ɉˑ�����ESR�X�y�N�g�����x�̌����ׁA�X�s���A�_�N�g�� �R���̐M���ł��邱�Ƃ��m�F���Ă���B���̃t���[���W�J���ɂ��Ă����l�̕��@���g����B
�@
�R���̐M���ł��邱�Ƃ��m�F���Ă���B���̃t���[���W�J���ɂ��Ă����l�̕��@���g����B
�@
�@�X�s���g���b�s���O�@���J�����ꂽ1970�N��ɂ͕��ː��Ǝˉ��Ő�����A�~�m�_�̃��W�J����L�@���W�J���A�ߎ_�������琶������_�f���W�J���̌v���������Ȃ�ꂽ�B�������ɁA�����_�f�����ɊW����ߎ_�����f���琶������ ��HOO�E�̊ϑ��Ⴊ����Ă���B�܂��A�X�s���A�_�N�g��ʂ��\�ɂȂ��āA���x�_��W�J���邱�Ƃ��ł���悤�ɂȂ����B���̌�A�A�~�m�_�̕��ː��Ǝ˂̌����͐ϋɓI�ɐi�߂��A�~�m�_�̕��̓���Ȃǂ��s��ꂽ�B���ɂ��A�j�_�≖��̎_�������A�t���r���̌������A�A�~�m�_
�����A�y�v�`�h����ъj�_�̕��ː��ƎˁA�����ߎ_���������邢�͖̊������A�R���Ǎ܂̌����ɕ��L�����p���ꂽ8-11�j�B
��HOO�E�̊ϑ��Ⴊ����Ă���B�܂��A�X�s���A�_�N�g��ʂ��\�ɂȂ��āA���x�_��W�J���邱�Ƃ��ł���悤�ɂȂ����B���̌�A�A�~�m�_�̕��ː��Ǝ˂̌����͐ϋɓI�ɐi�߂��A�~�m�_�̕��̓���Ȃǂ��s��ꂽ�B���ɂ��A�j�_�≖��̎_�������A�t���r���̌������A�A�~�m�_
�����A�y�v�`�h����ъj�_�̕��ː��ƎˁA�����ߎ_���������邢�͖̊������A�R���Ǎ܂̌����ɕ��L�����p���ꂽ8-11�j�B
�@�����_�f�̌������d�v�ł���ƔF�������悤�ɂȂ����̂̓t���[�h�r�b�`�ɂ��SOD�̔����ȍ~�ŁA�����_�f���Y������y�f��D�����̎h����� �����̑���ɗ��p���ꂽ�B
�����̑���ɗ��p���ꂽ�B
�@�����_�f�̌v����DMPO �����p���ꂽ�̂́A�ߑ�����t���[���W�J���̈Ⴂ�ɂ���Ȃ�ESR�X�y�N�g����^���A�X�y�N�g���̉�͂��e�Ղł��������Ƃɂ��B�}5�� �AHO�E�A���f���q�iH�E�j�A�Y�f���S���W�J���iC�E�j��DMPO �X�s���A�_�N�g�̓T�^�I��ESR�X�y�N�g���������Ă���BPBN��POBN���g�����ꍇ�A���ꂼ��̃X�s���A�_�N�g�X�y�N�g�����ގ����Ă���A���W�J�����q�킪����Ă���͂��e�ՂłȂ��B
�@
�AHO�E�A���f���q�iH�E�j�A�Y�f���S���W�J���iC�E�j��DMPO �X�s���A�_�N�g�̓T�^�I��ESR�X�y�N�g���������Ă���BPBN��POBN���g�����ꍇ�A���ꂼ��̃X�s���A�_�N�g�X�y�N�g�����ގ����Ă���A���W�J�����q�킪����Ă���͂��e�ՂłȂ��B
�@
5�D�X�s���g���b�s���O�@�̍��x���p
5�D1�@���x�_�I���
�@ESR-�X�s���g���b�s���O�@�����I�v���@�ikinetic method�j�ɂȂ邱�Ƃ�1974�N�ɕ��ꂽ�B�t���[���W�J���̕ߑ��ʂ̓X�s���g���b�s���O�܂̔������x�ik�j�Ǝ���Z�x�iC�j�̐ςŌ��܂�B���̂��߁A�t���[���W�J���̐��������Ȃ��������┽�����̒Ⴂ�t���[���W�J���̌v���ł́A��荂�Z�x�̃X�s���g���b�s���O�܂�p���˂Ȃ�Ȃ��BDMPO�̔������x���ɂƂ�ƁA ��ߑ����锽�����x��16 M-1s-1�Ɣ��������Ⴍ�A�y�f�����Ő�������
��ߑ����锽�����x��16 M-1s-1�Ɣ��������Ⴍ�A�y�f�����Ő������� ���m���ɕߑ�����ɂ͍��Z�xDMPO�i1M�ȏ�j��p����K�v������B�_���������ŁADMPO��HOO�E�̔������x��6.6x103 M-1s-1�Ƃ̕�����B����AHO�E�ɑ���DMPO�̔������x
�́A3-5x109 M-1s-1�ł���15�j�B�����n��HO�E�ʂɂ���邪DMPO�Z�x��0.1��M�ȏ�ɂ���ƁAHO�E���ق�100���ߑ��ł���B
���m���ɕߑ�����ɂ͍��Z�xDMPO�i1M�ȏ�j��p����K�v������B�_���������ŁADMPO��HOO�E�̔������x��6.6x103 M-1s-1�Ƃ̕�����B����AHO�E�ɑ���DMPO�̔������x
�́A3-5x109 M-1s-1�ł���15�j�B�����n��HO�E�ʂɂ���邪DMPO�Z�x��0.1��M�ȏ�ɂ���ƁAHO�E���ق�100���ߑ��ł���B
�@DMPO-�X�s���g���b�s���O�@���g���ăL�T���`���_���y�f�iXOD�j��NADPH�_���y�f�Ȃǂ̍y�f�������x�����߂邱�Ƃ��ł���16,17)�BXOD�����ɂ����āA��ł���q�|�L�T���`���iHPX�j�̔Z�x��ω�������1���Ԃɐ������� �̗ʂ����߁A�}6�Ɏ������悤��Lineweaver-Burk�v���b�g���邱�ƂŁA�y�f�������x�Ɖ𗣒萔�iVmax��km�j�����܂�B
�̗ʂ����߁A�}6�Ɏ������悤��Lineweaver-Burk�v���b�g���邱�ƂŁA�y�f�������x�Ɖ𗣒萔�iVmax��km�j�����܂�B
�@�t���[���W�J�������͂̑���́A�}7�Ɏ������悤�ɃX�s���g���b�s���O����ƃt���[���W�J���ɑ��锽������(��������)�Ƃ̋��������𗘗p���đ��肳���B�\1�� �ɑ�������͂x�_�I�ɉ�͂������ʂ��������BHO�E�̏����͂ɂ��Ă����l�̌���������Ă���BESR�@�ł͂��̓�̏����͂��A�X�[�p�[�I�L�V�h�@�X�J�x���W���O�@�A�r���e�C�iSOSA�j�ƃq�h���L�V���W�J���X�J�x���W���O�@�A�r���e�C�iHRSA�j�ƌĂ�18-20)�B
�ɑ�������͂x�_�I�ɉ�͂������ʂ��������BHO�E�̏����͂ɂ��Ă����l�̌���������Ă���BESR�@�ł͂��̓�̏����͂��A�X�[�p�[�I�L�V�h�@�X�J�x���W���O�@�A�r���e�C�iSOSA�j�ƃq�h���L�V���W�J���X�J�x���W���O�@�A�r���e�C�iHRSA�j�ƌĂ�18-20)�B
�@SOSA�̑���́A�̉t�i���t�C���t�C�A�j��畆�g�D�A����Ȃǂɉ��p�ł���B�܂��A�R���Ǎ܁A�R�_���܁A������܂Ȃǂ̑�����ł���B
�@SOSA�̑���l�́A���Y����ESR�X�y�N�g����50%���������Z�x�iIC50�j�ŕ\�����B
�@�\1��SOD��W������Ƃ��e���܂̏��������𑪒肵�Ă��邪�ASOD�� �����\�����̕����ɔ�ׁA��тʂ��ċ����B
�����\�����̕����ɔ�ׁA��тʂ��ċ����B
����ɁAIC50�̒l���g���āA���x�_�I�Ȏ�舵�����ł���̂ŁA�\1�̂悤��SOSA�����x�萔�Ƃ��ċ��߂邱�Ƃ��ł���B
�@�������x�萔�����߂�v�Z���́A�X�s���g���b�s���O�܁iDMPO�j�Ə��������iS�j���������Ă���n��z�肵�ċL�q�����B�����n������ʂ� �����������ƁA
�����������ƁA ��DMPO,�@S�̗����Ɣ�������2��ނ̔������ԑ̂���B
��DMPO,�@S�̗����Ɣ�������2��ނ̔������ԑ̂���B
 + DMPO�@
+ DMPO�@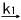 �@DMPO-
�@DMPO- �i��1�j
�i��1�j
 + S�@�@�@�@
+ S�@�@�@�@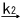 �@S-
�@S- �i��2�j
�i��2�j
�����ŁAk1�Ck2�͊e�������x�萔�ł���B����ƁA�������x���͎��̂悤�ɂȂ�B
d[DMPO- ] / dt = k1 [DMPO][
] / dt = k1 [DMPO][ ] �i��3�j
] �i��3�j
d[S- ] / dt = k2 [S][
] / dt = k2 [S][ ] �i��4�j
] �i��4�j
���i3�j�Ǝ��i4�j����DMPO- �̌����ʂ́A���������ɂ���ĒD����
�̌����ʂ́A���������ɂ���ĒD���� �̗ʂƓ������͂��ł��邩��A2�̔������ɂ͎��̊W�����藧�B
�̗ʂƓ������͂��ł��邩��A2�̔������ɂ͎��̊W�����藧�B
d[DMPO- ] / dt �Fd[S-
] / dt �Fd[S- ] / dt = (1-X) �FX �i��5�j
] / dt = (1-X) �FX �i��5�j
�����ŕϐ�X��DMPO- �̌������i0��X��1�j��\���B���i3�j���玮�i5�j�������,���̎���������B
�̌������i0��X��1�j��\���B���i3�j���玮�i5�j�������,���̎���������B
k2 = k1�oX / (1-X)�p�E�o[DMPO] / [S]�p �i��6�j
DMPO- ��50����������ꍇ�iX=0.5�̂Ƃ��j��6�͍X�Ɋȗ��������B
��50����������ꍇ�iX=0.5�̂Ƃ��j��6�͍X�Ɋȗ��������B
k2 = k1 [DMPO] / IC50 �i��7�j
�@���̂悤�ɁA�t���[���W�J�����������́AIC50�ŕ\�������ꍇ�i���Βl�j�Ƒ��x�萔�i��Βl�j�ŕ\�����ꍇ������B
�@HO�E�̌����� �Ɠ��l�ŁA�����n�Ə����n�̌���������B�����n�Ƃ��Ă̓t�F���g���������悭�m���Ă���BDMPO ���g���āA�t�F���g�������Ő�������HO�E�̒�ʂ��s���A�t�F���g�������̔������x�����߂鎎�݂��R���ɂ���čs�Ȃ��Ă���B�����悤�ɁA�����g�Ǝ˂ɂ���Đ��̕����Ő�������HO�E�̒�ʂ��A�q���ɂ���ĕ���Ă���B�l�X��HO�E���������̔������x�����肳��Ă���21-22)�B
�Ɠ��l�ŁA�����n�Ə����n�̌���������B�����n�Ƃ��Ă̓t�F���g���������悭�m���Ă���BDMPO ���g���āA�t�F���g�������Ő�������HO�E�̒�ʂ��s���A�t�F���g�������̔������x�����߂鎎�݂��R���ɂ���čs�Ȃ��Ă���B�����悤�ɁA�����g�Ǝ˂ɂ���Đ��̕����Ő�������HO�E�̒�ʂ��A�q���ɂ���ĕ���Ă���B�l�X��HO�E���������̔������x�����肳��Ă���21-22)�B
�@�V�����X�s���g���b�s���O�܂̊J���́A�X�s���g���b�s���O�@���������W�J�������ɉ��p����Ă��邱�Ƃ��������Ƃ������āADMPO�̗މ��������̍����𒆐S�ɐi�߂��Ă���B
�@�}8�ɂ́ADMPO����т��̗މ��������ƃX�s���A�_�N�g�̍\���������Ă���23-26)�B
�@�V�K�X�s���g���b�s���O�܂̕��q�v���s���ɓ�����C�X�s���g���b�s���O�܂̋@�\�Ƃ��āA�X�s���A�_�N�g�̎����A�������x���d�v�ł���B�܂�A�V���������DMPO�ɔ�r���āA �ɑ��Ă͔������������AHO�E�ɑ��Ă͒Ⴂ�Ƃ������������锽���������߂���B����ɁA�����̃A�_�N�g�̎����������A��͂��e�Ղł���K�v������B�����āA����̉��i�������łȂ��ƕ��L�������ɗp���邱�Ƃ��ł��Ȃ��B
�ɑ��Ă͔������������AHO�E�ɑ��Ă͒Ⴂ�Ƃ������������锽���������߂���B����ɁA�����̃A�_�N�g�̎����������A��͂��e�Ղł���K�v������B�����āA����̉��i�������łȂ��ƕ��L�������ɗp���邱�Ƃ��ł��Ȃ��B
�@�����̗v����������V���ȃX�s���g���b�s���O�܂Ƃ��ĊJ�����ꂽ�̂��ADMPO�މ��������ł���DPPMPO�ł���B�}9�ɂ́AXOD�n�Ő������� �ƃt�F���g�������Ő�������HO�E��ESR�X�y�N�g�����������BDMPO�̐M���ɔ�ׂ�ƁA�X�y�N�g���͕��G�ł��邪�A��͂͗e�Ղł���BHfcc���\2�Ɏ������B����ɋ��߂���̂̓X�s���A�_�N�g�̎����ŁA�Z�����̃t���[���W�J���̒�ʐ������߂邱�Ƃ��ł���B�\3�ɂ́ADPPMPO�ɕߑ����ꂽ
�ƃt�F���g�������Ő�������HO�E��ESR�X�y�N�g�����������BDMPO�̐M���ɔ�ׂ�ƁA�X�y�N�g���͕��G�ł��邪�A��͂͗e�Ղł���BHfcc���\2�Ɏ������B����ɋ��߂���̂̓X�s���A�_�N�g�̎����ŁA�Z�����̃t���[���W�J���̒�ʐ������߂邱�Ƃ��ł���B�\3�ɂ́ADPPMPO�ɕߑ����ꂽ �X�s���A�_�N�g�̎��������ŕ\�������ADMPO�ɔ�ׂ�ƁA������8�{�ł������B����
�X�s���A�_�N�g�̎��������ŕ\�������ADMPO�ɔ�ׂ�ƁA������8�{�ł������B���� ��HO�E�ɑ��锽�����x���\4�Ɏ������BDPPMPO�͔������x��DMPO��3�{�ŁA�ߑ������������Ƃ����������B�����̓����̓X�s���g���b�v�@�̐V���ȉ��p�W�J���\�Ƃ���BDPPMPO����͌����ł���ADMPO�̂悤�ɒ����ۑ��ɂ�镪�����N����Ȃ��A����ɗn����������̎���������ł���ȂǁA�]���̎���ɂȂ�
������L������B
��HO�E�ɑ��锽�����x���\4�Ɏ������BDPPMPO�͔������x��DMPO��3�{�ŁA�ߑ������������Ƃ����������B�����̓����̓X�s���g���b�v�@�̐V���ȉ��p�W�J���\�Ƃ���BDPPMPO����͌����ł���ADMPO�̂悤�ɒ����ۑ��ɂ�镪�����N����Ȃ��A����ɗn����������̎���������ł���ȂǁA�]���̎���ɂȂ�
������L������B
7�D�܂Ƃ�
�@�{�e�ł�ESR-�X�s���g���b�s���O�@�̐����Ɛ������W�J�������ւ̉��p�ɂ��ďq�ׂ��B�����_�f�����̑�����DMPO�ɂ���ĂȂ���Ă������A���̎���̌��_��₤�X�s���g���b�s���O�܂̊J�����i�߂��A�V��������̊J��������������B�V���ɊJ�����ꂽDPPMPO������ɋ�������邱�ƂɂȂ�A�����_�f�E�t���[���W�J�������ւ̗��p�����҂ł���B���ɁA�������זE��|�{����זE�A�畆�\�ʂ̉��ǗU�������ȂǂɊ����_�f�����̑��肪�\�ƂȂ�B
�@����A�����̐������W�J�������҂��V���������Ƃ��āA�V��������������邱�Ƃ����҂������B
�Q�l����
1) D. T. Sawyer and J. S. Valentine., Acc. Chem. Res., 1981, 14, 393.
2) B. M. Babior, J. T. Gurnutte and B. J. McMurrich, J. Clin. Invest., 1976, 58, 989.
3) E. Wertz and J. B. Bolton,"Electron Spin Resonance" McGraw-Hill, New York, 1972.
4) H. M. Swartz, J. R. Bolton and D. C. Borg, "Biological Application of Electron Spin Resonance," Wiley-Intersciece, New York, 1972.
5) �����C�R���~���@�d�q�X�s�����A�u�k�ЃT�C�G���e�B�t�b�N, 1989.
6) �͖��O���@�d�q�X�s�����A�I�[���o�Ŏ�, 2003.
7) J. Parkins, Chemical Society, 1970, 24, 97.
8) C. Lagererantz, J. Phys. Chem., 1970, 75, 3466.
9) E. G. Janzen, Acc. Chem. Res., 1971, 4, 31.
10) E. G. Janzen and C. A. Evans, J. Am. Chem. Soc., 1973, 95, 8205.
11) J. R. Harbor, V. Chow and J. R. Bolton, Can. J. Chem., 1974, 52, 3549.
12) G. R. Buettner, Free Radic. Biol. Med., 1987, 3, 259.
13) E. Finkerstein, G. M. Rosen and E. J. Rauckman, J. Arch. Biochem. Biophys., 1980, 200, 16.
14) E. Finkelstein, G. M. Rosen, E. J. Rauckman and J. Paxtom, �gSpin trapping of Superoxide.�h Mol. Pharmacol. , 1979, 16, 676.
15) H. Miyazawa, T. Yoshikawa, M. Tanigawa, N. Yoshida, S. Sugino, M. Kondo, M. Nishikawa and M. Kohno, J. Clin. Biochem. Netr., 1988, 5, 1.
16) K. Mitsuta, Y. Mizuta, M. Kohno, H. Hiramatsu and A. Mori, Bull. Chem. Soc. Jpn., 1990, 63, 187-191.
17) M. Hiramatsu and M. Kohno, JEOL NEWS, 1987, 23A, 7-9.
18) M. Kohno, M. Kusai-Yamada, K. Mitsuta, Y. Mizuta and T. Yoshikawa, Bull. Chem. Soc. Jpn., 1991, 64, 1447-1453.
19) Y. Noda, M. Kohno, A. Mori and L. Packer, Methods in Enzymology, 1999, 299, 28-34.
20) I. Yamazaki and l. H. Piette, J. Biol. Chem., 1990, 265, 13589.
21) K. Makino, A. Hagi, H. Ide, A. Murakami and A. M. Nishi, Can. J. Chem., 1992, 70, 2818.
22) C. Frejiville, H. Karouni, B. Tuccio, F. Le Moigene, A. Mercier, A. Rockenbauer and P. Tordo, J. Chem. Soc. Chem. Commun., 1994, 15, 1793.
23) N. Sankurati and E. G. Janzen, Tetrahedron Lett., 1996, 37, 5313.
24) P. Tsai, K. Ichikawa, C. Mailar, S. Pou, H. J.halpern, B. Robinson, R. Nielsen and P. M. Rosen, J. Org. Chem., 2003, 68, 7811.
25) O. Inanami, T. Yamamori, T. A. Takahashi, H. Nagahata and M. Kuwabara, Free Radic. Res., 2000, 34, 81.
26) K. Shioji, S. Tsukimoto, H. Tanaka and K. Okuda, Chem. Lett., 2003, 32, 604-605.
���ҏЉ�
| ���� | �͖�@��O�iMasahiro Kohno�j |
| ���� | ���k��w�����Ȋw�Z�p���������Z���^�[ �ʎq���������H�w�n������ |
| �A���� | ��980-8579 �{�錧���s�t��r�����t6-6-10 TEL: 022-795-4113�@FAX: 022-795-4110 E-mail:mkohno@niche.tohoku.ac.jp |
| �o�g��w | ���Q��w�����w�����w�� |
| �w�� | ���m�i���w�A��w�j |
| �����e�[�} | ���C�����w�iESR�j�A���������w�A���Ȋw |
| ���� | �����_�f�E�t���[���W�J���̂��ׂāi�ۑP�j�A���Ɗ����_�f�i�I�[���Ёj�A�킩��₷���R�ہE�E�ۂ̊�b�m���i�I�[���o�Łj�A�d�q�X�s�������u�i�I�[���o�Łj�A���_���d�𐅂̊�b�m���i�I�[���o�Łj |