Q&A
ビオチンはアビジンに対して高い親和性(105M-1)を持つことが知られており、ビオチン-アビジン複合体を用いたシステムはEIA(エンザイムイムノアッセイ)などの免疫学的測定や組織染色の分野で広く利用されています。 抗体やタンパク質にビオチンラベル化後、酵素標識または蛍光標識されたアビジン、ストレプトアビジンなどを反応させ、酵素反応により生じた可視色素や標識された蛍光色素を検出するといった方法が行われます。
弊社では、各官能基に対するビオチン化剤ならびにアミノ基標識用のビオチンラベル化キットを販売しております。
ラベル化のタイプは以下のものを用意しております。
・ アミノ基標識用:活性エステルタイプ(Succinimidyl Biotin)ε-アミノ基などの遊離のアミノ基(-NH2)と結合します。
・ SH基標識用:マレイミドタイプ(Maleimide Biotin)システインなどのチオール基(-SH)と結合します。
・ 還元糖末端標識用:ヒドラジドタイプ(Hydrazide Biotin)糖の還元末端のアルデヒド基(-CHO)と結合します。
●キット
Q1 Biotinylation Kitには[BK01][BK02]の2種類がありますが、どのように違うのですか。
A1 一般用とBIACORE®用があります。
BIACORE®用はBiacore社のSPR装置に適する緩衝剤をセットとしております。また、Biacore社用のチップの洗浄及び再生用の薬品が入っております。
上記の装置を使用しないラベル化であれば、一般用(メーカーコード:BK01)のものをご使用ください。
Q2 キット以外に必要なものがありますか。
A2 一般的な器具があれば、本キットだけでビオチンラベル化できます。器具としては、マイクロピペッター(10 μl, 200 μl, 500 μl)、メスシリンダー、フラスコなどをご用意ください。
タンパク質に幾つのビオチンが結合したかを確認される場合は、HABA法に必要なavidin, HABA, DMSOを準備してください。HABA法に関してはカタログのプロトコールをご覧下さい。
Q3 Biotinylation Kitに入っているBiotin-(AC5)2 Sulfo-OSuは単品でも買えますか。
A3 単品でも販売しております。また、スペーサーの長さ(ビオチンと結合残基との距離)が違うものもございますので、目的に合わせてお選び下さい。
●アミノ基標識用(Succinimidyl Biotin)
Q4 Biotinの-OSuタイプにも、AC5 や(AC5)2などスペーサーの長さが違うものがありますが、性能はどのように違うのですか。
A4 アビジンのビオチン認識部位は深部にあるために、Biotin- OSuよりもBiotin-AC5-OSuでラベル化した方が認識されやすいと言われています。一方、タンパク質をビオチンで標識する場合も、標識部位が深部にあるとビオチン化してもアビジンが認識されない可能性があります。その場合もスペーサーは長いものが有利と考えられます。使用するタンパク質により、使い分けて下さい。
Q5 アミノ基標識用にはOSuとSulfo-OSuの2種類がありますが、どのように使い分けるのでしょうか。
A5 反応性に関してはほぼ同じですが、Sulfo-OSuタイプは、スルホン酸基がついているため水に対する溶解性が高く、高濃度での反応が出来ます。その反面吸湿しやすく、保存しているときに加水分解しやすくなります。
Q6 抗体がPBSに溶解してあるので、反応をPBSで行いたいのですが、問題ないでしょうか。
A6 ラベル化反応の条件としては弱アルカリ側(pH7〜9)が適しているので、その範囲内にpHを調整したPBSを使用してください。PBSの場合は、中性付近で使用することが多く、アルカリ側での緩衝能が十分でないことも考えられます。他の緩衝液(炭酸緩衝液やHEPESなど)に比べるとpH変動が幾分あるかもしれませんが、反応は出来ます。 pHに注意してご使用下さい。
Tris bufferやGlycine bufferはアミノ基をもっていますので、活性エステルタイプの緩衝液としては使用できません。
Q7 ラベル化すると、抗体やタンパク質の性質が変わったり、機能に問題が生じることがありますか。
A7 ラベル化される部位やラベル化率により、そのようなことが起こる可能性は十分あります。
Q8 Succinimidyl typeは水溶液中で不安定ということですが、通常の反応条件でどのくらい分解するのでしょうか。
A8 文献によると、pH8.2、25℃、4時間で約60% -OSuが残ってるという報告もあります。
Q9 ラベル化する時に注意することはありますか。
A9 ・ ラベル化時のpHは中性〜弱アルカリ性にして下さい。
pHがずれると反応が進行しないことがあります。
・ 試料の濃度が薄くならないようにして下さい。
試料濃度が薄いとラベル化の進行が遅くなることがあります。また、液量が多いとビオチン化タンパク質の最終濃度が薄くなったり、ゲルろ過している間に溶出したりします。
・ 溶けている試料の量を把握して下さい。
ラベル化率を求める時に必要になります。
●SH基標識用(Maleimide Biotin)
Q10 IgGをFab'にしてSH基との反応を行いたいのですが、Fab' はどのように作成すればよいのでしょうか。
A10 IgG からのFab'作成方法を弊社カタログのプロトコールに掲載しております。こちらを参考にしてください。
Q11 IgM型の抗体にビオチンを標識したいのですが出来ますか。
A11 基本的には、Fab'型にして、ヒンジ部のSH基を利用して、 Maleimideタイプで標識できます。
しかし、IgMでの報告は確認しておりません。
文献等によると、IgMはOSu型でアミノ基に標識する方法や抗体糖鎖還元末端にBiotin-AC5-hydrazideで標識方法もあります。
○●還元糖末端標識用 (Hydrazide Biotin)
Q12 糖鎖のアルデヒド基にビオチンヒドラジドをシッフ塩基としてつけて、ビオチンを使って分離精製後、シッフ塩基を加水分解して糖を回収することを考えています。
1.酸、アルカリでシッフ塩基は加水分解するか。
2.糖を分解させないように中性でシッフ塩基を加水分解できないか。
3.カラム精製中にシッフ塩基は加水分解するか。
4.精製中シッフ塩基が切れないようするには還元した方が良いか。
A12
1.加水分解します。
2.シッフ塩基は平衡反応なので、糖のアルデヒドよりも安定なシッフ塩基を作るアルデヒド基を持つものを加えると、加水分解して外れます。
3.条件によっては精製中に加水分解します。糖をつけると水溶性となり、水系でのカラム精製になります。その際にカラムの担体が触媒となり、加水分解することもあります。
4.還元してシッフ塩基をアミンの形にすれば、加水分解して切れることはなくなります。ただし、後でビオチンを切ることは出来なくなります。
●共通
Q13 ビオチンラベル化したサンプルの保存はどのようにすればよいのでしょうか。
A13 防腐剤として0.1%のアジ化ナトリウムを添加して、冷蔵で保存して下さい。
Q14 HABA法でラベル化率を算出する際の注意事項はありますか。
A14 ビオチン化タンパク質の濃度が高い場合、値が頭打ちになります。タンパク質溶液添加後の吸光度が0.7以下になる場合は溶液を希釈して測定して下さい。また反応時のpHは、7.0〜7.6で行なって下さい。
pH8以上になるとHABAとアビジンが結合しません。
Q15 HABA法を使用してビオチン化率を算出しているのですが、なかなか正確な値が出ません。その他の実験からもタンパク質がビオチン化されていることは明らかなのですが、HABA-Assay以外の方法でラベル化率を算出する方法がありましたら教えてください。
A15 条件等が違うので一概には言えませんが、正確な値が得られないのは、吸光度測定時の濃度が最適でない可能性があります。文献(N. M. Green, Methods in Enzymol., 18,418 (1970).)によると、ビオチン濃度やタンパク濃度が高いと誤った結果を与えることがあるようです。(A14参照)
HABA法以外のビオチン化量測定法としては、2,6-ANS(2- anilinonaphthalene-6-sulfonic acid)を用いる方法があります。HABA法と同様の原理で蛍光測定する方法です。この方法は感度が良いのでタンパク質の濃度が薄い場合に有効な方法だと思われます。下記文献を参考にして下さい。
D. M. Mock, Methods in Enzymol.,184,234 (1990).
Q16 Biotinと反応させるのはアビジンとストレプトアビジンどちらがよいのでしょうか。
A16 どちらでも結構です。
アビジンは塩基性が高く、糖側鎖を含むのに対し、ストレプトアビジンは非常に低い等電点を示し炭化水素基を含まないため非特異的結合が非常に少ないという特徴があります。しかし、その分ストレプトアビジンの方が高額です。これらの点をふまえ、選択いただければと思います
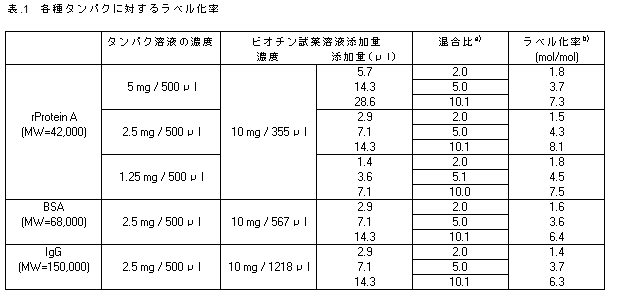
下記結果は、Biotinylation kitでの実測データで、条件により若干変動する可能性があります。 |
また、HABA法によりラベル化率を算出しました。 |
a) タンパク1 molに対して混合したビオチン試薬のモル数 |
b) タンパク1 molに結合したビオチンのモル数 |

BIACORE®はBiacore社の登録商標です。 |