(株)同仁化学研究所 佐々本 一美
狂牛病(BSE)のパニックが日本を襲っているが、本場イギリスでもBSEからの感染と考えられる変異型クロイツフェルト・ヤコブ病(vCJD)の患者数は既に110名を越え、依然として増加している。 これまで、牛の病気で人への感染はないと考えられていたBSEだが、1996年3月、イギリス健康保険省が公式に感染を認めたのが今日のパニックの発端となっている。 良く知られているように、原因となるプリオン蛋白質は正常脳組織にも発現しており(正常プリオンPrPC)、これが何らかの作用で b-シート構造に富んだアイソフォームに移行し(異常プリオンPrP Sc)、脳内に凝集することで神経疾患を引き起こすと考えられている。 最大の謎は、PrPCからPrPScへの2次構造の変換がどのように起こるかであるが、アミロイドーシス同様、詳細な機構は分かっていない。 b-シート蛋白質が自己触媒的に凝集していくのは他のアミロイド蛋白質と同じだが、大きな違いはプリオン蛋白質が感染することである。 生命体とは言えない単なる物質が感染・伝播していく不思議さは、多くの科学者の関心を引いている。
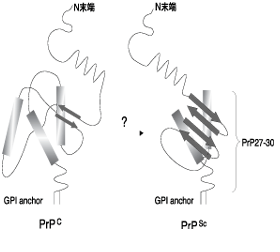
現在PrPScの検出は、脳組織をホモジネートし、プロテアーゼで処理し得られるN末端側が除去された142アミノ酸からなるコア部分(PrP27-30、図1)を、抗体を用いて検出する方法で行われている(BSEの場合、ELISAによる一次スクリーニング、更に Western blot及び組織免疫染色による確定診断が行われている)。 vCJDの場合は若年で発症しており、しかも、発症してからの進行が早い。 PrPScは、例外的に羊のリンパ組織で検出されるが、それ以外、BSEやvCJDでは潜伏期の生前診断は不可能である。
無論、血液などを用いる生前診断を可能にする抗体の開発は世界中で競って行われているが、そのためには、血中などの微量 PrPScを検出できる感度が必要である。 勿論それは、単に現在の抗体検出の感度では検出できないだけで、極微量は存在しているという前提である。 そうであれば、PCRのように人工的にPrP Scを増幅できれば解決する。 僅かのPrPSc が核となって、体内で次々にPrPCをPrP Scに変えていく感染のプロセスと基本的に同じである。

図1 プリオン蛋白質の2次構造(209アミノ酸)
Saborioら1)はprotein-misfolding cyclic amplification(PMCA)と呼ばれる増幅システムを考案した(図2)。 スクレイピー感染ハムスターの脳ホモジネートをPrPScが検出できなくなるまで希釈し、それを正常のハムスターの脳ホモジネートと37℃でインキュベートするとPrPScが検出されてくる(proteinase K で処理し、PrP27-30 を検出)。 界面活性剤の存在下で超音波処理を行うと凝集体を分散させることができるので、更に同様のサイクルで増幅することが可能である。 原理は簡単だが、重要なポイントはPrPCの供給源として脳ホモジネートを用いていることである。 精製したPrPCをPrPScと接触させることで、PrP C→PrPScの変換が起こることは知られていたが 2)、その系では効率は非常に悪く増幅することはできない。 つまり、凝集反応を促進する何らかの因子(例えば Protein X3))の存在が必須で、ホモジネートを用いる必要がある。 PrP CからPrPScへのリフォールディングを触媒するシャペロン分子の存在が疑われているが、それはPrP Sc自身かも知れない。
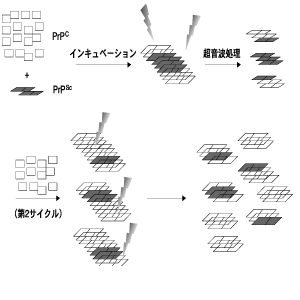
図2 PMCAサイクル
報告された検出感度は、10,000 倍以上の希釈で、10回のPMCAサイクルを行い、6〜12 pg(0.2〜0.4 amol)のPrPScの検出が可能である。 PrP Scというテンプレート無しでは、in vitroでPrPScを作り出すことができないなど、プリオン病の謎はまだ多いが、少なくともin vivoでの現象を利用した今回の技術は、プリオン病の早期診断に貢献することは確かである。
参考文献
1) G. P. Saborio, B. Permanne and C. Soto, Nature, 411, 810 (2001).
2) D. A. Kocisko, J. H. Come, S. A. Priola, B. Chesebro, G. J. Raymond,
P. T. Lansbury amd B. Caughey, Nature, 370, 471 (1994).
3) S. B. Prusiner, Proc. Natl. Acad. Sci., 95, 13363 (1998).