Q&A
Q1. SOD Assay Kit - WSTの測定原理を教えてください。
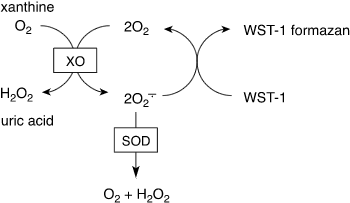
A1. 本キットの測定原理は下記の通りです。

| 図1.SOD Assay Kit - WSTの測定原理 xanthineとxanthine oxidaseから発生したsuperoxide(O2 -)が、どれぐらい消去されたかをWST-1の発色により調べ、消去能をsuperoxide dismutase(SOD)活性とします。 |
Q2. 他の測定方法とはどのように違うのでしょうか?
A2. SOD活性を測定する方法としては、シトクロムc法、NBT 法、エピネフリン法および亜硝酸法などが知られています。 xanthine/xanthine oxidaseをスーパーオキシド生成系とし、テトラゾリウム塩の還元反応を利用したNBT法は操作が簡便 であることから汎用されていますが、生成するホルマザンが 不溶性の沈殿物であることや、NBTがxanthine oxidaseと直接反応し100%SOD阻害率を測定することができない等の 問題をかかえています。WST-1はxanthine oxidaseと直接反応しないため、100%SOD阻害率を測定できます。
Q3. 他のメーカーから販売されているキットとはどのように違う のでしょうか?
A3. 現在販売されているキットは2種類あります。A社のキット
はNBTを用いているため(Q2)100%SOD阻害率を測定することができないということの他に、生成するホルマザンが
不溶性であることから試薬中に界面活性剤を含んでおり、ピ
ペッティング時に気泡を生じる等操作性でも問題があります。
また、B社から販売されているキットは、1つの測定サンプル
を調製するのに数分要するためマイクロプレートを用いるこ
とができず、一度に多検体を測定するということができません。
それに比べ本キットは、水溶性ホルマザンを生成するWST-
1を使用しているためSOD阻害率も0〜100%まで測定することができますし、ピペッティング時に気泡を生じると
いったこともございません。また、マイクロプレートを使用
し、一度に多検体の測定を行うことができます。
Q4. キット以外に必要なものは何ですか?
A4. キット以外に準備していただくものは下記の通りです。
・ プレートリーダー (450 nmフィルター)
・ 96 well プレート
・ 2-20 μl と 20-200 μl のマルチチャンネルピペット
・ インキュベーター
・ superoxide dismutase(SOD;阻害率の較正をする場合のみ)
Q5. マイクロプレートリーダーを持っていないのですが、測定で きますか?
A5. 測定サンプルを希釈するか、もしくは測定サンプルや試薬等
全ての量を増やすことで、分光光度計でも測定は可能です。た
だし試薬等の量を増やして測定を行った場合測定できるサン
プル数が減ってしまいますので、サンプル数を減らしたくな
い場合はサンプルを希釈して測定を行ってください。
また吸光度が不足する場合には、インキュベートの時間を
プロトコールの20分から30分もしくは40分程度に延ばすことで対応できます。なお、測定には400〜450nmのフィ
ルターをお使いください。
Q6. このキットでどのくらいの検体を測定することができるので しょうか?
A6. 96 wellのマイクロプレートを使用して測定を行った場合、1 キットで500検体の測定を行うことができます。
Q7. キットの保存はどのようにすればいいのでしょうか?また、 どのくらい保存できますか?
A7. 本キットは冷蔵庫(0〜5℃)で保存してください。
キットを開封し、試薬等の希釈を行った場合、それぞれの溶
液は以下の期間使用することが可能です。
・ WST working solution(WST solution 1 mlをBuffer
solution 19 mlで希釈)
希釈後0〜5℃保存で2ヶ月使用できます。
・ Enzyme working solution(Enzyme solution 15μlをDilution buffer 2.5 mlで希釈)
希釈後0〜5℃保存で2週間使用できます。
Q8. どのような試料を測定することができますか?
また、その前処理方法について教えてください。
A8. 測定対象試料としては、血清, 血漿, 細胞, 組織, 食品等です。また、試料の前処理については、血清, 血漿は、そのままもしくは純水で希釈してお使いいただけます。全血からの赤血球の 採取方法についてはTsuchihashi法(Q9)をご参照ください。 その他の試料については弊社までお問い合わせください。
Q9. Tsuchihashi法とはどのような方法でしょうか?
A9. 以下に血漿、もしくは赤血球の測定試料とする場合の前処理
の例を示しますが、有機溶媒によるヘモグロビン除去の方法
の1つ(次項図2の四角で囲んだ部分)です。
ただし、このTsuchihashi法ではヘモグロビンが変性して除
かれる他に、Mn-SODも失活するとされるので、Mn-SODを有する細胞や組織にはこの方法は利用できず、灌流等によ
る脱血が必要となります。

図2. 血漿及び赤血球試料の調製
(講談社「活性酸素測定マニュアル」より)
Q10. 測定に妨害を与える物質にはどのようなものがあります か?
A10. アスコルビン酸、グルタチオン(還元型)等還元物質は正誤
差を与えます。これらの物質が下記の濃度存在した場合10
%程度のO.D.値の上昇が認められますが、O.D.値の上昇は blank 2として差し引くことにより影響は回避できます。
・ascorbic acid 0.1 mmol/l
・glutathione, reduced form 5 mmol/l
・bovine serum albumin (BSA) 5 %w/v
(BSAはO.D.値の上昇はありませんが、SOD様活性を示し
ますのでこれよりも高濃度にはならないようにして下さい)
Q11. サンプルを希釈する際には、水で希釈してもいいのでしょうか?
A11. サンプルの希釈には添付のDilution bufferもしくは生理食塩水をお使いください。
Q12. 反応時間は厳密にしなくてはいけないのでしょうか?
A12. プロトコールではインキュベート時間を20分としていま
すが、インキュベートの時間が10分〜60分の間で変わっても、得られるIC
50値(反応の阻害率が50%)は変わりません(図3)。ただし、吸光度は時間と共に上昇していき
ますので、ブランクとサンプルはインキュベートの時間が
常に同じになるようにして下さい。
また、Enzyme working
solutionを加えるとすぐにsuperoxideの発生が始まりますので、well間のタイムラグ
をできるだけ少なくするために測定にはマルチチャンネル
のピペットをお使いください。
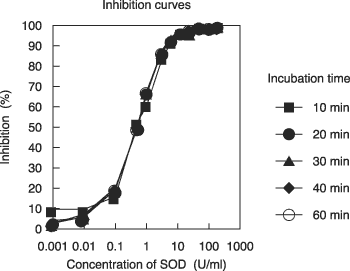
| 図3. インキュベート時間10分〜60分の間で10分おきに測定し、阻害
曲線を作成した。 wavelength 450 nm SOD:Sigma cat.#S2515,from bovine erythrocytes |
Q13. SOD活性値はどのようにして求めればよいですか?
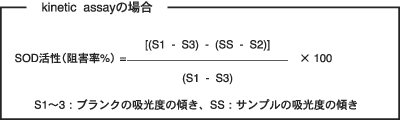
A13. SOD活性値は、一定時間(プロトコールでは20分)のイ ンキュベート後の吸光度の値から求められますし(end- point assay)、また、吸光度変化の傾きからも求めることができます(kinetic assay)。kinetic assayの場合、吸光度の上昇が直線を示すような適当なインキュベート時間から傾 きを求めてください。特にインキュベート開始後15〜20分の間では、吸光度の上昇は良好な直線性を示します。
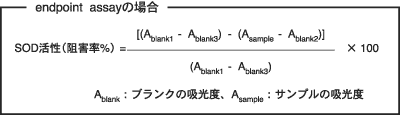
それぞれの場合、SOD活性値は次の計算式により求められます。
| 品 名 | 容量 | 価格(¥) | メーカコード |
| SOD Assay Kit - WST | 500tests | 18,000 | S311 |