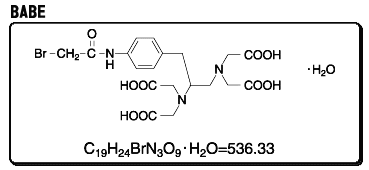

丂EDTA偼Fe僀僆儞傪寢崌偡傞偲丄娨尦忦審壓偱儔僕僇儖傪敪惗偟惗懱崅暘巕傪愗抐偡傞惈幙傪傕偭偰偄傑偡丅DNA寢崌抈敀幙偺DNA忋偺寢崌晹埵傪丄FeEDTA偵傛傞愗抐掞峈惈椞堟偲偟偰摨掕偡傞乽DNA僼僢僩僾儕儞僥傿儞僌朄乿丄抈敀幙暋崌懱拞偱昞柺偵業弌偟偨晹暘傪愗抐姶庴惈椞堟偲偟偰挷傋傞乽僾儘僥僀儞僼僢僩僾儕儞僥傿儞僌朄乿偼丄嵟嬤偺惗柦壢妛偱偼峀偔棙梡偝傟偰偄傑偡丅FeEDTA偺偙偺斀墳惈傪棙梡偟丄抈敀幙偺摿掕晹埵偵FeEDTA傪寢崌偟丄偦偺廃曈偺愙怗偡傞妀巁傗抈敀幙傪摨掕偟丄傑偨愙怗揰傪摨掕偡傞栚揑偱丄BABE乮p-bromoacetamidobenzyl EDTA乯偑惗柦壢妛尋媶偵峀偔棙梡偝傟傞傛偆偵側偭偰偒傑偟偨丅
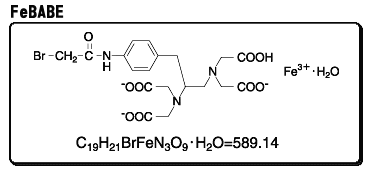
丂BABE偼丄摉弶丄嬥懏傪惗懱暔幙偵寢崌偝偣傞壦嫶帋栻偲偟偰奐敪偝傟丄EDTA晹埵偵曻幩惈111In3亄傪寢崌偝偣丄峈庮釃惈峈惗暔幙偱偁傞僽儗僆儅僀僔儞A2偺枛抂偵寢崌偟丄偦偺廤愊偱儅僂僗偺庮釃晹埵傪摨掕偡傞側偳偺丄栻棟妛揑丒椪彴揑側棙梡偑寁傜傟偰偒傑偟偨丅嵟嬤偵側偭偰丄Fe僀僆儞傪寢崌偟偨BABE乮FeBABE乯偑抈敀偺儁僾僠僪寢崌偲妀巁儂僗儂僕僄僗僥儖寢崌偺椉曽傪慖戰揑偵丄偟偐偟傾儈僲巁攝楍丒僰僋儗僆僠僪攝楍偵娭學側偔丄旕摿堎揑偵愗抐偡傞妶惈偑拲栚偝傟丄偦偺桳梡惈偑擣傔傜傟偨偙偲偱岠棪揑崌惉朄偑奐敪偝傟傑偟偨丅
丂抈敀寢崌惈偺EDTA壔崌暔偼堦斒偵Meares帋栻偲屇偽傟傑偡丅BABE偼bromoacetamido寢崌偵傛偭偰丄抈敀幙偺僔僗僥僀儞巆婎偺SH婎偲壏榓側忦審偱斀墳偟傑偡丅抈敀幙偺揤慠偺僔僗僥僀儞巆婎偁傞偄偼堚揱巕岺妛揑庤朄偵傛偭偰摫擖偟偨僔僗僥僀儞巆婎偵丄Fe僀僆儞傪寢崌偟偨BABE乮FeBABE乯傪寢崌偟丄傾僗僐儖價儞巁偲夁巁壔悈慺傪壛偊傞偲妶惈儔僕僇儖偑敪惗偟丄儔僕僇儖旘掱嫍棧撪偺妀巁傗抈敀幙偺庡嵔偺愗抐偑婲偒傑偡丅偙偺愗抐斀墳偼昩扨埵偱恑峴偡傞偺偱丄斀墳偼10昩偐傜10暘掱搙偺抁帪娫偱恑峴偟丄FeBABE偺暘巕峔憿偐傜悇掕偟偰丄抈敀幙僔僗僥僀儞巆婎偐傜12侌偺埵抲偵Fe僀僆儞偑攝抲偝傟傞偨傔丄奐楐偡傞偺偼偦偺廃曈偵尷傜傟傑偡丅愗抐屄強傪僰僋儗僆僠僪攝楍傗傾儈僲巁攝楍偐傜夝愅偡傞偙偲偱丄愙怗偟偰偄偨憡庤暔幙偲偦偺暘巕忋偺愙怗揰傪摨掕偡傞偙偲偑弌棃丄抈敀幙旕寢崌宆偺愗抐帋栻偱偼摼傜傟側偄丄抈敀幙偺嶰師尦峔憿偵娭偡傞忣曬傑偱傕摼傞偙偲偑偱偒傑偡丅妀巁偺愗抐偵娭偟偰偼僸僪儘僉僔儖儔僕僇儖傪夘偟偨巁壔揑側斀墳偵傛傞傕偺偲峫偊傜傟偰偄傑偡偑丄儁僾僠僪寢崌愗抐偺婡峔偲偟偰偼偦傟埲忋偵丄揝偵攝埵偟偨儁儖僆僉僜拞娫懱偵傛傞僇儖儃僯儖扽慺偺媮妀峌寕愢偑採彞偝傟偰偄傑偡丅
丂嵟嬤丄抈敀幙偺儕僕儞巆婎傗枛抂傾儈僲婎偵丄2-iminothiolane乮2-IT乯傪夘嵼偝偣傞偙偲偱丄FeBABE傪寢崌偡傞墳梡朄偑奐敪偝傟偨偙偲偵埶偭偰丄FeBABE偺棙梡斖埻偼偝傜偵奼戝偟偰偒傑偟偨丅
丂FeBABE偺抈敀亅抈敀憡屳嶌梡偺愙揰夝愅偵棙梡偟偨椺偲偟偰偼丄戝挵嬠僠僩僋儘乕儉bd僆僉僔僟乕僛偺僒僽儐僯僢僩I偲嘦偺愙揰偺摨掕丄戝挵嬠RNA億儕儊儔乕僛偺兛丆兝丆兝乫丆冃僒僽儐僯僢僩娫偺愙揰偺摨掕側偳偑偁傝傑偡丅堦曽丄妀巁愗抐偐傜抈敀幙偺寢崌椞堟傪摨掕偟偨尋媶偲偟偰偼丄戝挵嬠RNA億儕儊儔乕僛偺堚揱巕僾儘儌乕僞乕寢崌堟偺摨掕傗丄儕儃僝乕儉抈敀幙偺RNA寢崌揰偺摨掕側偳偑偁傝傑偡丅
丂偙偺傛偆偵崅暘夝擻偺峔憿忣曬偑摼傜傟側偄暋嶨側抈敀幙廤崌懱偺僒僽儐僯僢僩撪丄偁傞偄偼丄偝傜偵偦傟傜偲憡屳嶌梡偡傞妀巁暘巕偲偺嬻娫揑娭學傪夝柧偡傞偺偵桳岠偱偁傝丄崱屻峀偔棙梡偝傟傞偲婜懸偝傟傑偡丅崱夞丄FeBABE偼搥寢姡憞昳偲梟塼僞僀僾傪梡堄偄偨偟傑偟偨丅搥寢姡憞昳偼悈丄娚徴塼丄DMSO側偳偱梟夝偟偰屼巊梡偔偩偝偄丅梟塼僞僀僾偼抈敀傊偺寢崌偵昁梫側墫婎傪挷惢偟偰偁傝傑偡偺偱偡偖偵梡偄傞偙偲偑偱偒傑偡丅
