ホタルの発光に代表される生物発光は昔から多くの化学者を魅了してきた。特に、現在知られている生物発光の中では最も発光効率が高い(量子収率=0.88)ホタル・ルシフェリン-ルシフェラーゼ発光系は、これまで分析化学への応用が盛んに行われてきた。ATPの検出1)や、あるいはそれを示標とする細胞のバイアビリティーの測定2)などが代表的な例であるが、近年、レポーター蛋白としてルシフェラーゼ活性を検出するreporter gene assayが応用の主流となってきており、現在ではGFPとならんで代表的な発光アッセイ系と言える。その理由として、この発光系が高感度であること、また殆どの細胞は本来ルシフェラーゼ活性を持たないことがあげられる。さらに最近、化学合成法の改良3)による安価な供給が可能になったことも一因として考えられる(cf.p.9)。
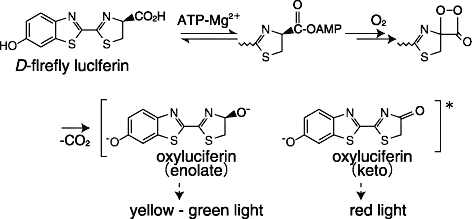
ホタル・ルシフェリン-ルシフェラーゼ発光系の反応は、ATPおよびMg2+の存在下、基質のD-ルシフェリンがルシフェラーゼによって発光体であるオキシルシフェリンに変換される反応である(Scheme)。実際のホタルでは、その種類によって緑から赤への発光が見られるが、これは酵素の違いによってエノール型ジアニオン(黄色〜緑)、もしくはケト型モノアニオン(赤)が発光体となるためである。発光はルシフェラーゼ濃度で8桁にわたって直線性があり、sub-attomoleレベルの検出感度が報告されている4)。ホタル・ルシフェリン-ルシフェラーゼ発光系のreporter gene assayへの反応は広汎に及ぶが、ここではごく最近の応用例、特に癌研究への応用について紹介したい。

Scheme Bioluminescent Reaction of Firefly Luciferin
Gnantらは、薬剤感受性を利用した自殺遺伝子治療法における遺伝子導入効率の解析にルシフェリン-ルシフェラーゼ発光系を用いている5,6)。(チミジンキナーゼ遺伝子を欠失させ)ルシフェラーゼ遺伝子を導入した組換えワクシニアウイルスベクターを作成し、マウス大腸癌の肝転移モデルに対して投与法や腫瘍集積性の検討を行ない、cytosine deaminase遺伝子と5-fluorocytosineとの組み合わせによる自殺遺伝子治療法が転移性肝癌に有効であることを示した。この他、前立腺癌7)、メラノーマ8)、カポシ肉種9)、乳癌10)などの遺伝子治療研究への応用も報告されている。
スタンフォード大学のContagらは、ルシフェラーゼ遺伝子をトランスフェクションしたHeLa細胞(HeLa-luc)を液性免疫と細胞性免疫がともに欠損したいわゆるSCIDマウスに接種し、腫瘍細胞の体内での増殖を発光でモニターする手法を報告している11)。この方法は、生きたマウスで腫瘍細胞の増殖を時間を追って観察でき、非侵襲的、高感度、定量性に優れた方法である。彼等はまず、25-250,000個のHeLa-luc細胞を(予め放射線を照射した)SCIDマウスの腹腔内に接種し、全身から発生するフォトンをイメージング用カメラで捕え可視化した(基質のルシフェリンはイメージングの直前に腹腔投与)。腹腔部分に広がった腫瘍細胞からの発光量は接種した細胞数に比例し、検出感度は2,500cells(接種数)であった。次に、抗癌剤の効果を調べるために予め10,000個のHeLa-luc細胞を接種したSCIDマウスにcyclophosphamide、5'-fluorouracil、cisplatinをある間隔で投与し、4週間モニターした。その結果、cyclophosphamideでは殆ど腫瘍増殖の抑制効果は見られなかったが、5'-fluorouracilでは、初期には抑制するが、2-3週目から増殖に転じる様子が捕えられた。また、cisplatinは顕著な抑制効果を示した。
この方法により、腫瘍の増殖、再増悪、転移、薬物への応答などの動的な情報を直接発光画像として捕らえることができ、癌治療への新たな試みとして注目される。
参考文献
1)P. E. Stanley, Methods Enzymol., vol.133, p14, Academic Press, 1986.
2)S. P. M. Crouch, R. Kozlowski, K. J. Slater and J. Fletcher, J. Immunol. Mothods, 160, 81(1993).
3)Y. Toya, M. Takagi, H. Nakata, N. Suzuki, M. Isobe and T. Goto, Bull. Chem. Soc. Jpn., 65, 392(1992).
4)I. Bronstein, J. Fortin, P. E. Stanley, G. S. Stewart and G. S. Kricka, Anal. Biochem., 219, 169(1994).
5)M. F. Gnant, L. A. Noll, K. R. Irvine, M. Puhlmann, R. E. Terrill, H. R. Alexander Jr and D. L. Bartlett, Ann. Surg., 230, 352(1999).
6)M. F. Gnant, M. Puhlmann, D. L. Bartlett and H. R. Alexander Jr, J. Natl. Cancer Inst., 91, 1744(1999).
7)D. C. Yu, G. T. Sakamoto and D. R. Henderson, Cancer Res., 59, 1498(1999).
8)B. J. Park, C. K. Brown, Y. Hu, H. R. Alexander, J. Horti, S. Raje and W. D. Figg, Human Gene Ther., 10, 889(1999).
9)J. A. Campain, A. A. Matassa, P. L. Felgner, K. M. Barnhart, D. T. Curiel and G. S. Harrison, Cancer Gene Ther., 5, 131(1998).
10)X. S. Li, A. K. Rishi, Z. M. Shao, M. I. Dawson, L. Jong, B. Shroot, U. Reichert, J. Ordonez and J. A. Fontana, Cancer Res., 56, 5055(1996).
11)T. J. Sweeney, V. Mailander, A. A. Tucker, A. B. Olomu, W. Zhang, Y. Cao, R. S. Negrin and C. H. Contag, Proc. Natl. Acad. Sci., U.S.A. 96, 12044(1999).