|
チオール誘導体による自己組織単分子膜を用いた 生体機能解析 |
| 関連商品 |
Self-Assembled Monolayer研究用試薬
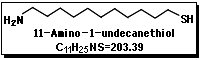
11-Amino-1-undecanethiol
アルキルチオール類を金表面に吸着させ自己組織化単分子膜 (Self-Assembled Monolayer)を形成する方法は、欠陥の少ない単分子膜を容易に作成できるため近年、金修飾電極、表面プラズモン共鳴(SPR;Surface Plasmon Resonance)、水晶発振子マイクロバランス(QCM;Quartz Crystal Microbalance)を利用した電気化学的な検出に利用され注目されている。
いずれも表面に金を蒸着し、これにチオールあるいはジスルフィドを用いてプローブ分子を固定し、それぞれ電流変化、反射角、水晶発振子の振動数変化で検出する。これらの自己組織化膜の性質は、そのアルキル鎖の長さや末端の官能基の変更、主鎖の親水性などによって変えることができ、多彩な機能を持たせることができると期待される。既にSPRを用いた分析機器やQCMを利用した匂いセンサーはあるが、さらに分子認識性能を向上させたセンサーが期待されている49)。ここに紹介する11-Amino-1-undecanethiolは末端にアミノ基を有しており、例えばペプチドや蛋白、その他の分子認識サイトを導入する際に有用であると思われる。Takeharaらは金電極表面に11-Amino-1-undecanethiolの単分子膜を形成し、表面上に結合された電気化学活性種のredox応答における金電極上に形成した単分子膜の末端基の効果を検討している49)。またTanahashiらは11-Amino-1-undecanethiolを始めとする各種チオールの単分子膜を金表面に作成しヒト血漿モデル溶液中でアパタイト形成をQCMを用いて観察し、末端置換基による形成速度の違いについて検討している50)。