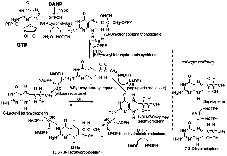
|
NOS inhibitors inhibition by non-amino acid isothioureas & others |
| Inhibitor | NOS | EC50(IC50) | 文献 |
| S-Methyl-ITU | macropharge iNOS | 6.0μM | 1) |
| rat macropharge J774.2-cell(iNOS) |
6.0μM(L-NMMA:48μM) 8.0μM |
2) 6) |
|
| vascular smooth muscle cell | 2.0μM | 1) | |
| S-Ethyl-ITU |
rat macropharge J774.2-cell(iNOS) (eNOSやnNOSに対しても20〜30倍選択的) |
2.0μM 21μM |
2) 6) |
| S-Isopropyl-ITU | rat macropharge J774.2-cell(iNOS) | 2.0μM | 2) |
| S-Aminoethyl-ITU |
rat macropharge J774.2-cell(iNOS) (eNOSに対しても6倍強力であるが昇圧効果は弱い) |
2.0μM | 2) |
| 2-Iminopiperidine | human iNOS | 1.0μM(L-NIL:4.6μM) | 5) |
| eNOS | 4.7μM | 5) | |
|
nNOS (eNOS/iNOSでは、L-NILが選択的) |
1.1μM(L-NIL:61μM) | 5) | |
| rat macropharge J774.2-cell |
10μM(L-NMMA:70μM) (L-NNA:210μM) |
6) | |
| 3-Br-7-Nitroindazole | rat cerebellum(nNOS) | 0.17μM(7-NI:7.1μM) | 13,14) |
| bovine endothelial(eNOS) | 0.86μM(7-NI:7.8μM) | 13,14) | |
| rat lung(iNOS) | 0.29μM(7-NI:5.8μM) | 13,14) |

| Price List | 価格(¥) | ||
| S-Methyl-ITU | 344-07251 | 1g | 8,500 |
| S-Ethyl-ITU | 341-07261 | 1g | 8,500 |
| S-Aminoethyl-ITU | 348-07271 | 1g | 8,500 |
| 2-Iminopiperodeine | 346-07331 | 100mg | 9,200 |
| DHAP | 345-07301 | 1g | 5,500 |
| 3-Br-7-Nitroindazole | 342-07291 | 25mg | 9,200 |
| APDC | 345-07281 | 1g | 7,500 |
| S-Isopropyl-ITU | 344-07371 | 25mg | 9,500 |