| ジチオカルバメート化合物による in vivo NO イメージング/高いNO消去活性と耐還元性を持つリポソーム化PTIO誘導体 |

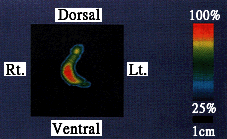
| Tissue | NO-Fe-DTCS complex* |
|
Liver Kidney Whole blood Urine |
96.0±10.8 nmol/g (wet tissue) 19.8±1.3 9.4±1.5 nmol/ml 13.8±2.6 |
| 【NOスピントラップ剤】 | 価格(¥) | ||
| DTCS Na | 349-07321 | 100mg | 8,600 NEW |
| 345-07323 | 500mg | 36,000 NEW | |
| MGD | 50mg | 3,500 | |
| 500mg | 9,600 | ||
| 【NO消去剤】 | |||
| TMA-PTIO | 342-07311 | 10mg | 9,400 NEW |
| 348-07313 | 100mg | 52,000 NEW | |
| Carboxy-PTIO | 344-07011 | 10mg | 9,400 |
| 340-07013 | 100mg | 52,000 | |
| 【NO発生剤】 | |||
| NOC5 | 347-06881 | 10mg | 6,500 |
| 343-06883 | 50mg | 26,000 | |
| NOC7 | 344-06891 | 10mg | 6,500 |
| 340-06893 | 50mg | 26,000 | |
| NOC12 | 347-06901 | 10mg | 6,500 |
| 343-06903 | 50mg | 26,000 | |
| NOC18 | 344-06911 | 10mg | 6,500 |
| 340-06913 | 50mg | 26,000 | |
| NOR1 | 341-06921 | 10mg | 6,500 |
| 347-06923 | 50mg | 26,000 | |
| NOR2 | 348-06931 | 10mg | 6,500 |
| 344-06933 | 50mg | 26,000 | |
| NOR3 | 345-06941 | 10mg | 6,500 |
| 341-06943 | 50mg | 26,000 | |
| NOR4 | 342-06951 | 10mg | 6,500 |
| 348-06953 | 50mg | 26,000 | |
| 【ニトロソチオール類】 | |||
| SNAP | 346-07071 | 25mg | 12,000 |
| 342-07073 | 100mg | 35,000 | |
| S-Nitroso-L-cysteine溶液 | 340-07351 | 1ml×5 | 19,000NEW |
| S-Nitrsoglutathione | 347-07361 | 25mg | 9,600NEW |
| 343-07363 | 100mg | 26,000 NEW | |
| 【NO合成酵素(NOS)阻害剤】 | |||
| L-NMMA | 345-07161 | 25mg | 5,000 |
| L-NIO | 349-07181 | 10mg | 7,000 |
| Diphenyleneiodonium chloride | 342-07171 | 10mg | 6,500 |
| L-Thiocitrulline | 346-07191 | 10mg | 7,000 |
| S-Methyl-L-thiocitrulline | 348-07151 | 10mg | 7,500 |
| L-NAME | 340-07231 | 1g | 5,000 |
| L-NNA | 346-07211 | 1g | 5,000 |
| L-NIL | 347-07241 | 25mg | 5,000 |
| 7-Nitroindazole | 343-07221 | 50mg | 4,000 |
| 3-Br-7-Nitroindazole | 342-07291 | 25mg | 9,200NEW |
| S-Isopropyl-ITU | 344-07371 | 25mg | 9,500NEW |
| S-Methyl-ITU | 344-07251 | 1g | 8,500NEW |
| S-Ethyl-ITU | 341-07261 | 1g | 8,500NEW |
| S-Aminoethyl-ITU | 348-07271 | 1g | 8,500NEW |
| APDC | 345-07281 | 1g | 7,500NEW |
| DAHP | 345-07301 | 1g |
5,500NEW |
| 2-Iminopiperidine | 346-07331 | 100mg | 9,200NEW |
| 【パーオキシナイトライト関連試薬】 | |||
| SIN-1 | 342-06831 | 25mg | 9,200 |
| Peroixynitrite溶液 | 1ml×5 | 18,800(送料込み) | |
| 【NO測定用】 | |||
| 2,3-Diaminonaphthalene(・NO測定用) | 341-07021 | 10mg | 3,300 |
| 【NO測定用蛍光試薬キット】 | |||
| NO 2 /NO 3 Assay Kit-F(Fluorometric) | 344-07131 | 100回用 | 19,000 |
| 【NO測定用比色試薬キット】 | |||
| NO 2 /NO 3 Assay Kit-C(Colormetric) | 341-07141 | 100回用 | 19,000 |